题目内容
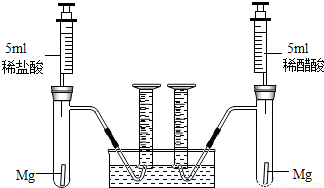
根据不同种金属与同种酸能否反应以及反应的剧烈程度,可判断金属的活动性。也可根据同种金属与不同种酸反应的快慢,来判断不同种酸的酸性强弱。为比较盐酸和醋酸的酸性,设计了如下实验方案,装置如下图所示(夹持和固定装置已略去)。在两试管中分别加入过量镁条,同时将相同浓度的稀盐酸和稀醋酸注入相应试管中,观察产生氢气的速率和体积。
试回答下列问题:
(1)盐酸与镁反应的化学方程式为_________________;基本反应类型为______________。
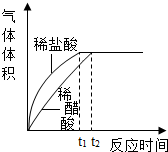
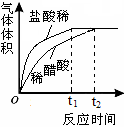
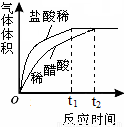
(2)实验中收集到氢气的体积与时间的关系如下图所示。分析图中曲线变化规律,可得出盐酸酸性比醋酸____(填“强”或“弱”)。
(1)盐酸与镁反应的化学方程式为_________________;基本反应类型为______________。
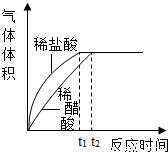
(2)实验中收集到氢气的体积与时间的关系如下图所示。分析图中曲线变化规律,可得出盐酸酸性比醋酸____(填“强”或“弱”)。
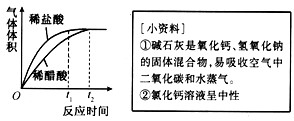
(3)实验中稀盐酸与镁条反应时,量筒中收集到氢气的体积比理论值高,可能的原因是____(填序号)。
①反应放热;②试管中有氢气残留;③实验装置气密性不好;④酸液进入试管,占据了一定的体积
①反应放热;②试管中有氢气残留;③实验装置气密性不好;④酸液进入试管,占据了一定的体积
(1)Mg+2HCl==MgCl2+H2↑;置换反应
(2)强
(3)①④
(2)强
(3)①④

练习册系列答案
相关题目
 32、根据不同种金属与同种酸能否反应以及反应的剧烈程度,可判断金属的活动性.也可根据同种金属与不同种酸反应的快慢,来判断不同种酸的酸性强弱.为比较盐酸和醋酸的酸性强弱,设计了如下实验方案.装置如图所示(夹持和固定装置已略去).在两试管中分别加入过量镁条,同时将相同浓度的稀盐酸和稀醋酸注入相应试管中,观察产生氢气的速率和体积.
32、根据不同种金属与同种酸能否反应以及反应的剧烈程度,可判断金属的活动性.也可根据同种金属与不同种酸反应的快慢,来判断不同种酸的酸性强弱.为比较盐酸和醋酸的酸性强弱,设计了如下实验方案.装置如图所示(夹持和固定装置已略去).在两试管中分别加入过量镁条,同时将相同浓度的稀盐酸和稀醋酸注入相应试管中,观察产生氢气的速率和体积.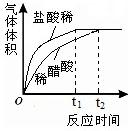
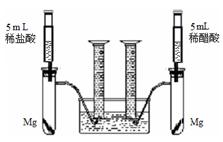
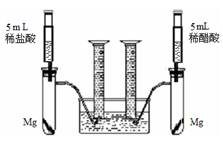
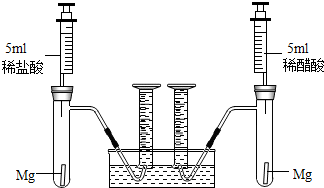 根据不同种金属与同种酸能否反应以及反应的剧烈程度,可判断金属的活动性.也可根据同种金属与不同种酸反应的快慢,来判断不同种酸的酸性强弱.为比较盐酸和醋酸的酸性强弱,设计了如下实验方案.装置如图所示(夹持和固定装置已略去).在两试管中分别加入过量镁条,同时将相同浓度的稀盐酸和稀醋酸注入相应试管中,观察产生氢气的速率和体积.
根据不同种金属与同种酸能否反应以及反应的剧烈程度,可判断金属的活动性.也可根据同种金属与不同种酸反应的快慢,来判断不同种酸的酸性强弱.为比较盐酸和醋酸的酸性强弱,设计了如下实验方案.装置如图所示(夹持和固定装置已略去).在两试管中分别加入过量镁条,同时将相同浓度的稀盐酸和稀醋酸注入相应试管中,观察产生氢气的速率和体积.