题目内容
为确定气体X(可能为H2、CO、CH4的一种),将X点燃,将其产生通过A、B两个洗气瓶,无明显现象,B中溶夜可使酚酞变红
(一)试回答:(1)A中盛有______溶液,B中液体应为______.
(2)填表√表示增加,×表示不变.
(3)若X为纯净或混合物,当AB质量均增加时,X组成最多为______种,X为纯净物时,若B增m克A则增加______克.
(二)可选用装置(如示意图铁架台未画)
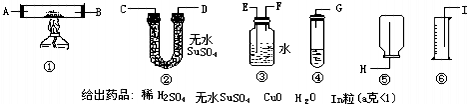
给出药品:稀H2SO4,无水CuSO4、CuO、H2O、Zn粒(a克<1),利用以上条件,设计最简单实验,粗测锌原子相对质量.(假定标况下实验H2密度0.08928g/L)
(1)选用装置按顺序为(写装置标号)______,各仪器接口连接顺序为(写接口字母)______.
(2)为H2产量尽量少损失,放试剂时操作为______.
(3)测得水为V升,所用Zn粒a克,则Zn原子量数学表达式为______.
(一)试回答:(1)A中盛有______溶液,B中液体应为______.
(2)填表√表示增加,×表示不变.
| A质量 | √ | × | √ |
| B质量 | × | √ | √ |
| X化学式 | ① | ② | ③ |
| 燃烧方程式 |
(二)可选用装置(如示意图铁架台未画)

给出药品:稀H2SO4,无水CuSO4、CuO、H2O、Zn粒(a克<1),利用以上条件,设计最简单实验,粗测锌原子相对质量.(假定标况下实验H2密度0.08928g/L)
(1)选用装置按顺序为(写装置标号)______,各仪器接口连接顺序为(写接口字母)______.
(2)为H2产量尽量少损失,放试剂时操作为______.
(3)测得水为V升,所用Zn粒a克,则Zn原子量数学表达式为______.
(一)(1)根据三种气体的燃烧产物,以及B中溶液显碱性,可知A应该选择浓硫酸,B应该选择氢氧化钠溶液;
(2)装置A的质量增加,B装置的质量不变,说明有水生成,没有二氧化碳气体生成,气体X是氢气;
若A装置的质量不变,B装置的质量增加,说明有二氧化碳生成,没有水生成,则气体X为一氧化碳;
若A装置和B装置的质量都增加,说明既有二氧化碳生成,也有水生成,则气体X是甲烷;
(3)若A装置和B装置的质量都增加,说明既有二氧化碳生成,也有水生成,则气体X(纯净或混合物)的可能组成有:CH4;H2、CO、CH4;CO、CH4;H2、CH4或H2、CO五种情况;若B增重mg,也就是生成mg的二氧化碳,设同时生成水的质量为x,则
CH4+2O2
CO2+2H2O
44 36
mg x
=
,x=
mg
(二)(1)从提供的药品可以看出求锌的相对原子质量的关系建立在锌与硫酸的反应,并对生成的氢气的体积进行测量,进而可求出氢气的质量,利用化学方程式可求锌的原子量,该设计选择装置,图中④是制取氢气的装置,③是收集氢气并排水的装置,⑥是测量排出水的体积,故答案为:③④⑥;
.制取氢气的装置在前,利用③装置排水时应是气体由短管通入,水由长管排出,用⑥测量出排出水的体积进而确定收集到的氢气的体积.故答案为:G→F→E→I;
(2)操作中,为了保证不漏出氢气,则注意加放试剂:向试管中加入足量的稀硫酸后,将试管斜放,再把锌片放在试管内壁上,塞紧塞子,将试管慢慢直立,让锌片滑下与硫酸接触发生反应;
(3)水的体积即是生成氢气的体积换算出氢气的质量,利用化学方程式进行计算可求出锌的原子量.由题意知:氢气的质量为:2
g.
设锌的相对原子质量为x
Zn+H2SO4═ZnSO4+H2↑
x2
ag 2
g
=
,x=
.
故答案为:(一)(1)浓硫酸;氢氧化钠溶液;
(2)①H2;2H2+O2
2H2O;②CO;2CO+O2
2CO2;③CH4;CH4+2O2
CO2+2H2O;
(3)五;
m;
(二)(1)③④⑥;G→F→E→I;
(2)向试管中加入足量的稀硫酸后,将试管斜放,再把锌片放在试管内壁上,塞紧塞子,将试管慢慢直立,让锌片滑下与硫酸接触发生反应;
(3)
.
(2)装置A的质量增加,B装置的质量不变,说明有水生成,没有二氧化碳气体生成,气体X是氢气;
若A装置的质量不变,B装置的质量增加,说明有二氧化碳生成,没有水生成,则气体X为一氧化碳;
若A装置和B装置的质量都增加,说明既有二氧化碳生成,也有水生成,则气体X是甲烷;
(3)若A装置和B装置的质量都增加,说明既有二氧化碳生成,也有水生成,则气体X(纯净或混合物)的可能组成有:CH4;H2、CO、CH4;CO、CH4;H2、CH4或H2、CO五种情况;若B增重mg,也就是生成mg的二氧化碳,设同时生成水的质量为x,则
CH4+2O2
| ||
44 36
mg x
| 44 |
| 36 |
| mg |
| x |
| 9 |
| 11 |
(二)(1)从提供的药品可以看出求锌的相对原子质量的关系建立在锌与硫酸的反应,并对生成的氢气的体积进行测量,进而可求出氢气的质量,利用化学方程式可求锌的原子量,该设计选择装置,图中④是制取氢气的装置,③是收集氢气并排水的装置,⑥是测量排出水的体积,故答案为:③④⑥;
.制取氢气的装置在前,利用③装置排水时应是气体由短管通入,水由长管排出,用⑥测量出排出水的体积进而确定收集到的氢气的体积.故答案为:G→F→E→I;
(2)操作中,为了保证不漏出氢气,则注意加放试剂:向试管中加入足量的稀硫酸后,将试管斜放,再把锌片放在试管内壁上,塞紧塞子,将试管慢慢直立,让锌片滑下与硫酸接触发生反应;
(3)水的体积即是生成氢气的体积换算出氢气的质量,利用化学方程式进行计算可求出锌的原子量.由题意知:氢气的质量为:2
| V(H2) |
| 22.4 |
设锌的相对原子质量为x
Zn+H2SO4═ZnSO4+H2↑
x2
ag 2
| V(H2) |
| 22.4 |
| x |
| ag |
| 2 | ||
2
|
| 22.4a |
| V(H2) |
故答案为:(一)(1)浓硫酸;氢氧化钠溶液;
(2)①H2;2H2+O2
| ||
| ||
| ||
(3)五;
| 9 |
| 11 |
(二)(1)③④⑥;G→F→E→I;
(2)向试管中加入足量的稀硫酸后,将试管斜放,再把锌片放在试管内壁上,塞紧塞子,将试管慢慢直立,让锌片滑下与硫酸接触发生反应;
(3)
| 22.4a |
| V(H2) |

练习册系列答案
相关题目