题目内容
【题目】通过比较相同时间内产生氧气的体积可探究影响过氧化氢分解速率的因素.
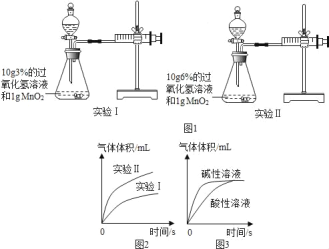
(1)用图1装置进行实验并绘制曲线图如图2.
写出实验I的化学反应方程式:_____,根据图1、图2信息可知,该因素对过氧化氢分解速率的影响是:_____.
(2)探究温度及催化剂质量的影响.请补填实验Ⅴ中的数据.
实验编号 | 温度 | 催化剂 | 过氧化氢溶液的质量及浓度 |
实验Ⅲ | 50℃ | 1g二氧化锰 | 10g,3% |
实验Ⅳ | 25℃ | 2g二氧化锰 | 10g,3% |
实验Ⅴ | _____ | _____ | 10g,3% |
(3)溶液酸碱性对过氧化氢的分解速率也有影响,如图3:
①分析图3,可得出的结论是:_____.
②资料表明:过氧化钡(BaO2)与硫酸(H2SO4)溶液反应可用来制取H2O2,同时生成一种白色沉淀硫酸钡(BaSO4)该反应的化学方程式为:_____;从反应后的混合物中除去硫酸钡沉淀的实验操作是:_____;根据①中结论可知,利用上述反应制取H2O2时,所加硫酸的量应:_____(填“少量”或“过量”).
【答案】![]() 在相同条件下,反应物的浓度越大,过氧化氢分解的速率越快 25℃ 2g二氧化锰2 在碱性溶液中过氧化氢的分解速率大于在酸性溶液中的分解速率,但不影响产物的最终质量 BaO2+H2SO4═H2O2+BaSO4↓ 过滤 过量
在相同条件下,反应物的浓度越大,过氧化氢分解的速率越快 25℃ 2g二氧化锰2 在碱性溶液中过氧化氢的分解速率大于在酸性溶液中的分解速率,但不影响产物的最终质量 BaO2+H2SO4═H2O2+BaSO4↓ 过滤 过量
【解析】
(1)过氧化氢在二氧化锰的催化作用下生成水和氧气,反应的化学方程式为:![]() ;两个实验中过氧化氢溶液质量分数不同,其它量相同,且坐标显示过氧化氢的浓度越大,等时间内产生的气体体积越大,因此得出的结论是:在相同条件下,反应物的浓度越大,过氧化氢分解的速率越快;
;两个实验中过氧化氢溶液质量分数不同,其它量相同,且坐标显示过氧化氢的浓度越大,等时间内产生的气体体积越大,因此得出的结论是:在相同条件下,反应物的浓度越大,过氧化氢分解的速率越快;
(2)探究温度及催化剂质量的影响,应该保持其它的量相同,改变的是温度或催化剂的质量,故答案为:25℃(或50℃);2g二氧化锰(或1g二氧化锰);
(3)①分析图3是探究进行溶液和酸性溶液对过氧化氢分解速率及产物的量的影响,通过坐标可得出的结论为:在碱性溶液中过氧化氢的分解速率大于在酸性溶液中的分解速率,但不影响产物的最终质量;
②根据资料过氧化钡(BaO2)与硫酸(H2SO4)溶液反应可用来制取H2O2,同时生成一种白色沉淀硫酸钡(BaSO4),因此反应的方程式为:BaO2+H2SO4═H2O2+BaSO4↓;硫酸钡难溶于水,因此用过滤法分离;为保证过氧化钡完全反应,加入硫酸的质量要过量,酸性环境也能促进过氧化氢的分解,且不影响氧气的产量。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案【题目】判断下列化学方程式中,属于分解反应的是( )
A. H2SO4+2NaOH═Na2SO4+2H2O
B. 2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
C. 2CO+O2![]() 2CO2
2CO2
D. Fe+CuSO4═FeSO4+Cu
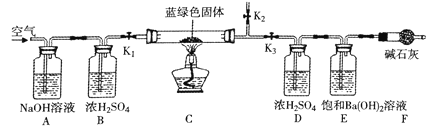
【题目】某同学将氢氧化钠溶液滴入到一定量的稀氯化铜溶液中,出现蓝绿色不溶于水的固体。该同学对生成蓝绿色而不是蓝色固体的现象产生疑惑。
(查阅资料)
(1)CuCl2溶液与NaOH溶液反应可生成蓝色固体(Cu(OH)2),在氢氧化钠较少的情况下会生成蓝绿色碱式氯化铜(Cux(OH)yClz),其不溶于水,能与酸反应。
(2)Cu(OH)2在60℃开始分解生成两种氧化物,100℃分解完全。碱式氯化铜在300℃开始分解生成氧化铜、水和氯化氢,在400℃分解完全。
(猜测)蓝绿色固体可能是:①Cu(OH)2;②Cux(OH)yClz晶体;③___。
猜想①的理由是:___(用化学方程式表示)。
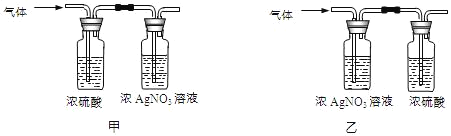
(实验)该同学取31.25g蓝绿色固体,加热至100℃出现黑色固体。则猜想___不正确。继续加热到400℃至质量不再改变,并使产生的气体全部缓缓通过如图___(选填“甲”或“乙”)装置(装置中药品足量)。
实验数据:①最终得到剩余固体24.00g;
②与硝酸银溶液反应得到的沉淀经过滤、洗涤和低温烘干,得到固体14.35g;
加热前 | 100℃ | 400℃ |
250.00g | 251.80g | 253.60g |
③浓硫酸装置中数据如表。
(延伸)
(1)碱式氯化铜常作为动物饲料的添加剂,则该碱式氯化铜与胃液发生反应的化学方程式为___。
(2)为使实验中生成蓝色固体,少出现蓝绿色固体,应作___改进(选填序号)。
a.实验中将氯化铜溶液滴加到氢氧化钠溶液中
b.实验中应提供足量、较浓的氢氧化钠溶液
c.实验应该在80℃的水浴中进行