题目内容
【题目】A B C D E F G为常见的物质,其中B E G属于单质,反应![]() 是炼铁中的主要反应,它们之间的相互转化关系如图所示:
是炼铁中的主要反应,它们之间的相互转化关系如图所示:

![]() 物质B的化学式是______;写出反应
物质B的化学式是______;写出反应![]() 的基本反应类型______。
的基本反应类型______。
![]() 写出C的一种用途:______。
写出C的一种用途:______。
![]() 写出反应
写出反应![]() 中生成红色固体E的化学方程式:______。
中生成红色固体E的化学方程式:______。
【答案】Fe 化合反应 灭火 ![]()
【解析】
解:E是红色固体单质,则E是铜,铜和氧气加热生成的A是氧化铜,A与过量的稀硫酸反应得到的X溶液中含有生成的硫酸铜和剩余的硫酸;反应![]() 是炼铁工业中的主要反应,即一氧化碳还原氧化铁生成铁和二氧化化碳,B能与X溶液反应生成铜和浅绿色溶液F,则B是铁,C是二氧化碳,F是硫酸亚铁,G是氢气,带入框图,推断合理;
是炼铁工业中的主要反应,即一氧化碳还原氧化铁生成铁和二氧化化碳,B能与X溶液反应生成铜和浅绿色溶液F,则B是铁,C是二氧化碳,F是硫酸亚铁,G是氢气,带入框图,推断合理;
![]() 是铁,X溶液中含有硫酸和硫酸铜两种溶质,反应
是铁,X溶液中含有硫酸和硫酸铜两种溶质,反应![]() 是铜和氧气加热生成氧化铜,属于化合反应,
是铜和氧气加热生成氧化铜,属于化合反应,
![]() 是二氧化碳,常用来灭火;
是二氧化碳,常用来灭火;
![]() 反应
反应![]() 中铁与硫酸铜反应生成红色固体铜和硫酸亚铁,方程式为:
中铁与硫酸铜反应生成红色固体铜和硫酸亚铁,方程式为:![]() 。
。
故填:![]() ;化合反应;
;化合反应;![]() 灭火;
灭火;![]() 。
。

【题目】某同学为了测定生铁样品中铁的质量分数,将60g 稀盐酸分3次加入到盛有4g 该样品的烧杯中(样品中只有铁与稀盐酸反应),所得数据如表,则下列说法中正确的是( )
实验次数 物质质量 | 第1次 | 第2次 | 第3次 |
加入稀盐酸的质量/g | 20 | 20 | 20 |
充分反应后剩余固体的质量 | 2.6 | 1.2 | 0.1 |
A. 第1次和第2次产生氢气的质量不同
B. 第2次和第3次剩余固体中均有铁
C. 第3次充分反应后溶液中溶质只有FeCl2
D. 生铁样品中铁的质量分数为97.5%
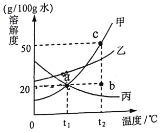
【题目】下表是KNO3、NaCl在不同温度下的溶解度。
温度(℃) | 0 | 20 | 30 | 40 | 60 | 80 | |
溶解度 | KNO3 | 13.3 | 31.6 | 45.8 | 63.9 | 110 | 169 |
NaCl | 35.7 | 36.0 | 36.3 | 36.6 | 37.3 | 38.4 | |
(1)根据表中的数据,在坐标纸上绘制出氯化钠和硝酸钾两种物质的溶解度曲线。(在答题卡的坐标纸上绘图)____
①两种物质中,溶解度受温度的影响变化较大的是_____。
②根据绘制的溶解度曲线可知,50℃时,硝酸钾的溶解度约为_____。
③将接近饱和的KNO3溶液转化为饱和溶液的一种方法是_____。
④从较浓的NaCl溶液中得到NaCl晶体,较好的方法是_____(填“蒸发结晶”或“降温结晶”)。
(2)A是80℃含有120g水的KNO3溶液,经过如下操作,得到102gKNO3固体。
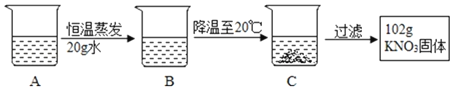
①A溶液为_____(选填“饱和”或“不饱和”)溶液。
②对以上过程的分析,正确的是_____(选填编号)。
a.A到B的过程中,溶质质量没有改变
b.B中溶质与溶剂的质量比为169:100
c.开始析出KNO3固体的温度在60℃至80℃之间
d.A溶液的质量等于222g
(3)烧杯内原有某物质,向其中加入物质X,X的质量与变量Y的关系如图,下列一定能正确反映X、Y对应关系的是_____。
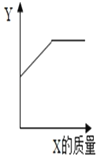
选项 | 烧杯内原有物质 | X | Y |
A | NaCl饱和溶液 | NaCl固体 | NaCl溶液的溶质质量分数 |
B | 水 | NH4NO3固体 | 溶液的温度 |
C | 氯化亚铁溶液 | 锌粉 | 溶液的质量 |
D | 稀硫酸 | 铁粉 | 溶液中氢元素的质量 |