题目内容
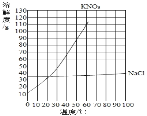
【题目】下表是KNO3、NaCl在不同温度下的溶解度。
温度(℃) | 0 | 20 | 30 | 40 | 60 | 80 | |
溶解度 | KNO3 | 13.3 | 31.6 | 45.8 | 63.9 | 110 | 169 |
NaCl | 35.7 | 36.0 | 36.3 | 36.6 | 37.3 | 38.4 | |
(1)根据表中的数据,在坐标纸上绘制出氯化钠和硝酸钾两种物质的溶解度曲线。(在答题卡的坐标纸上绘图)____
①两种物质中,溶解度受温度的影响变化较大的是_____。
②根据绘制的溶解度曲线可知,50℃时,硝酸钾的溶解度约为_____。
③将接近饱和的KNO3溶液转化为饱和溶液的一种方法是_____。
④从较浓的NaCl溶液中得到NaCl晶体,较好的方法是_____(填“蒸发结晶”或“降温结晶”)。
(2)A是80℃含有120g水的KNO3溶液,经过如下操作,得到102gKNO3固体。
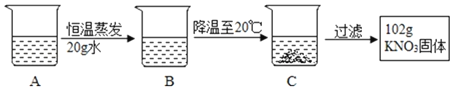
①A溶液为_____(选填“饱和”或“不饱和”)溶液。
②对以上过程的分析,正确的是_____(选填编号)。
a.A到B的过程中,溶质质量没有改变
b.B中溶质与溶剂的质量比为169:100
c.开始析出KNO3固体的温度在60℃至80℃之间
d.A溶液的质量等于222g
(3)烧杯内原有某物质,向其中加入物质X,X的质量与变量Y的关系如图,下列一定能正确反映X、Y对应关系的是_____。
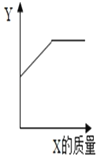
选项 | 烧杯内原有物质 | X | Y |
A | NaCl饱和溶液 | NaCl固体 | NaCl溶液的溶质质量分数 |
B | 水 | NH4NO3固体 | 溶液的温度 |
C | 氯化亚铁溶液 | 锌粉 | 溶液的质量 |
D | 稀硫酸 | 铁粉 | 溶液中氢元素的质量 |
【答案】 ; KNO3(硝酸钾); 85(±1)g; 加KNO3或蒸发水分或降温; 蒸发结晶; 不饱和 ac; C。
; KNO3(硝酸钾); 85(±1)g; 加KNO3或蒸发水分或降温; 蒸发结晶; 不饱和 ac; C。
【解析】
(1)依据表中的数据绘制氯化钠和硝酸钾两种物质的溶解度曲线,如图:
 ;
;
①通过分析溶解度曲线可知,两种物质中,溶解度受温度的影响变化较大的是硝酸钾;②通过分析绘制的溶解度曲线可知,50℃时,硝酸钾的溶解度约为85g;③硝酸钾的溶解度随温度的升高而增大,所以将接近饱和的KNO3溶液转化为饱和溶液的一种方法是:加KNO3或蒸发水分或降温;④氯化钠的溶解度受温度变化影响较小,所以从较浓的NaCl溶液中得到NaCl晶体,较好的方法是蒸发结晶;
(2)A是80℃含有120g水的KNO3溶液,经过如下操作,得到102gKNO3固体。
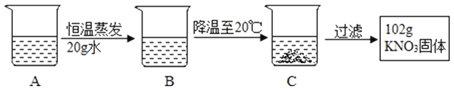
①A溶液恒温蒸发20g水没有晶体析出,所以A溶液为不饱和溶液;②a、A溶液恒温蒸发20g水没有晶体析出,所以A到B的过程中,溶质质量没有改变,此选项正确;b、B中溶质与溶剂的质量比为(102g+31.6g):(120g-20g)=133.6:100,此选项错误;c、B中含有100g水、(102g+31.6g)的硝酸钾,硝酸钾在80℃时的溶解度是169g,在60℃时的溶解度是110g,所以开始析出KNO3固体的温度在60℃至80℃之间,此选项正确;d、C溶液为20℃时,硝酸钾的饱和溶液,仍有部分硝酸钾还溶解在水中,所以A溶液的质量大于222g,此选项错误,故选ac。
(3)A、氯化钠饱和溶液中加入氯化钠固体,溶液质量分数不变,此选项错误;
B、硝酸铵溶于水,溶液温度降低,此选项错误;
C、Zn+FeSO4=ZnSO4+Fe,每65份质量的锌和硫酸亚铁反应生成硫酸锌和56份质量的铁,所以反应后溶液质量增加,当氯化亚铁溶液反应完以后,溶液的质量不变,此选项正确;
D、铁和稀硫酸反应生成硫酸亚铁和氢气,氢元素的质量逐渐减小,此选项错误。故选C。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
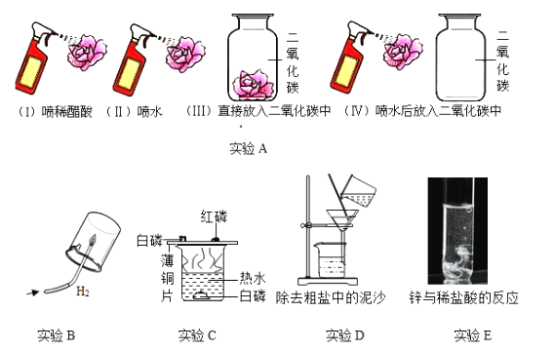
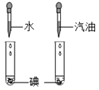
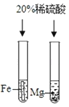
口算心算速算应用题系列答案【题目】下列对比实验设计不能实现相应实验目的是( )
选项 | A | B | C | D |
实验 目的 | 探究温度对分子 运动速率的影响 | 探究水对铁钉 锈蚀的影响 | 探究同种物质在不同溶剂中的溶解性 | 探究Mg、Fe金属的活动性强弱 |
实验 设计 |
|
|
|
|
A. AB. BC. CD. D