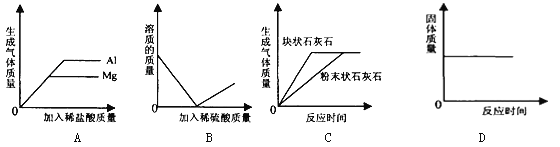
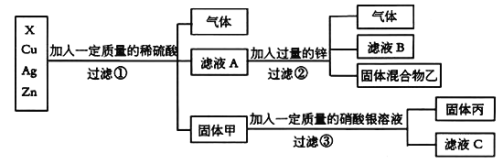
题目内容
【题目】(7分)某铁合金5.8g,与足量的稀硫酸充分反应,得到0.2g的氢气。请计算:
(1)该合金中铁的质量是多少克?
(2)该合金是生铁还是钢?(已知:生铁的含碳量是2%—4%,钢的含碳量是0.03%—2%)
【答案】(1)5.6g(2)生铁
【解析】
试题分析:(1)利用化学方程式,根据反应的质量比即可计算出铁的质量;
设铁的质量为x;
Fe + H2SO4 == FeSO4 + H2↑
56 2
X 0.2g
56/2 =x/0.2g
X=5.6g
(2)该合金中碳的质量=5.8g-5.6g=0.2g
碳元素的质量分数=0.2g/5.8g ×100% =3.4%,故属生铁。

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目