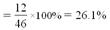题目内容
含一种杂质的CO2样品,经分析含氧元素的质量分数为80%,则可能混入了下列气体中的
| A.CO | B.SO2 | C.O2 | D.N2 |
C
二氧化碳中氧元素的质量分数为32/44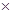 100%=73%
100%=73%
A、一氧化碳中氧元素的质量分数为16/28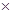 100%="57%," B、二氧化硫中氧元素的质量分数为32/64
100%="57%," B、二氧化硫中氧元素的质量分数为32/64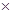 100%=50%,氧气中氧元素的质量分数为100%,D.氮气中氧元素的质量分数为0
100%=50%,氧气中氧元素的质量分数为100%,D.氮气中氧元素的质量分数为0
样品中氧的质量分数为80%,由此可知样品中的高,则杂质中氧的质量分数必定高于二氧化碳中的故选C
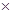 100%=73%
100%=73%A、一氧化碳中氧元素的质量分数为16/28
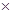 100%="57%," B、二氧化硫中氧元素的质量分数为32/64
100%="57%," B、二氧化硫中氧元素的质量分数为32/64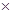 100%=50%,氧气中氧元素的质量分数为100%,D.氮气中氧元素的质量分数为0
100%=50%,氧气中氧元素的质量分数为100%,D.氮气中氧元素的质量分数为0样品中氧的质量分数为80%,由此可知样品中的高,则杂质中氧的质量分数必定高于二氧化碳中的故选C

练习册系列答案
相关题目