题目内容
12.5g含CaCO380%的石灰石与100g稀盐酸恰好完全反应,已知杂质不溶于水且不参加反应,求:(1)能生成二氧化碳多少克?(2)该盐酸溶液的溶质质量分数.分析:根据碳酸钙与盐酸反应的化学方程式和碳酸钙的质量,列出比例式,即可计算出生成二氧化碳的质量和盐酸中含HCl的质量;然后根据“盐酸溶液的溶质质量分数=
×100%”计算即可.
| 溶质质量 |
| 溶液质量 |
解答:解:参加反应的碳酸钙的质量=12.5g×80%=10g,
设生成二氧化碳的质量为x,盐酸中含HCl的质量为y,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 44
10g y x
=
=
x=4.4g;y=7.3g,
盐酸溶液的溶质质量分数=
×100%=
×100%=7.3g%.
答:(1)能生成二氧化碳的质量为4.4g;(2)该盐酸溶液的溶质质量分数为7.3%.
设生成二氧化碳的质量为x,盐酸中含HCl的质量为y,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 44
10g y x
| 100 |
| 10g |
| 44 |
| x |
| 73 |
| y |
x=4.4g;y=7.3g,
盐酸溶液的溶质质量分数=
| 溶质质量 |
| 溶液质量 |
| 7.3g |
| 100g |
答:(1)能生成二氧化碳的质量为4.4g;(2)该盐酸溶液的溶质质量分数为7.3%.
点评:本题主要考查学生运用化学方程式和溶质的质量分数公式解答问题的能力.

练习册系列答案
相关题目
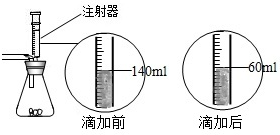 某化学兴趣小组在实验课上制取二氧化碳气体选择了下图的发生装置.在制取完毕后有同学提出该装置还能测得稀盐酸的质量分数.小娜同学称取12.5g含CaCO380%的石灰石粉末样品置于装置中,用注射器滴加稀盐酸至恰好完全反应,滴加前后的数据如如图所示:(杂质与稀盐酸不反应,稀盐酸的密度为1.25g/mL)
某化学兴趣小组在实验课上制取二氧化碳气体选择了下图的发生装置.在制取完毕后有同学提出该装置还能测得稀盐酸的质量分数.小娜同学称取12.5g含CaCO380%的石灰石粉末样品置于装置中,用注射器滴加稀盐酸至恰好完全反应,滴加前后的数据如如图所示:(杂质与稀盐酸不反应,稀盐酸的密度为1.25g/mL)