题目内容
(2009?宜昌模拟)12.5g含CaCO380%的石灰石与100g稀盐酸恰好完全反应,已知杂质不溶于水且不参加反应,求:(1)能生成二氧化碳多少克?(2)该盐酸溶液的溶质质量分数.
【答案】分析:根据碳酸钙与盐酸反应的化学方程式和碳酸钙的质量,列出比例式,即可计算出生成二氧化碳的质量和盐酸中含HCl的质量;然后根据“盐酸溶液的溶质质量分数= 100%”计算即可.
100%”计算即可.
解答:解:参加反应的碳酸钙的质量=12.5g×80%=10g,
设生成二氧化碳的质量为x,盐酸中含HCl的质量为y,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 44
10g y x
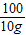 =
=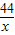 =
=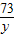
x=4.4g;y=7.3g,
盐酸溶液的溶质质量分数=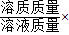 100%=
100%=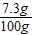 ×100%=7.3g%.
×100%=7.3g%.
答:(1)能生成二氧化碳的质量为4.4g;(2)该盐酸溶液的溶质质量分数为7.3%.
点评:本题主要考查学生运用化学方程式和溶质的质量分数公式解答问题的能力.
 100%”计算即可.
100%”计算即可.解答:解:参加反应的碳酸钙的质量=12.5g×80%=10g,
设生成二氧化碳的质量为x,盐酸中含HCl的质量为y,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 44
10g y x
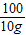 =
=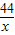 =
=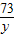
x=4.4g;y=7.3g,
盐酸溶液的溶质质量分数=
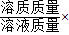 100%=
100%=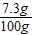 ×100%=7.3g%.
×100%=7.3g%.答:(1)能生成二氧化碳的质量为4.4g;(2)该盐酸溶液的溶质质量分数为7.3%.
点评:本题主要考查学生运用化学方程式和溶质的质量分数公式解答问题的能力.

练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目
(2009?宜昌模拟)生活中我们经常发现存放的铁钉会生锈.
(1)小牛和小明通过如图所示实验对铁制品生锈的条件进行探究.通过观察和分析:
最易生锈的是______(填序号),试管B中加入植物油的目的是______.我得出铁生锈的条件是______.
(2)在实验室用稀盐酸除铁锈的实验中,小牛认为盐酸中含有H2O、H+、Cl-三种粒子,为了探究稀盐酸中哪种粒子能使铁锈溶解,他进行了如下实验,我能帮他完成.
小明认为还需要补做一个“向装有锈铁钉的试管中加入水”的对比实验,我认为这个实验是多余的,理由是______.
小明在做铁钉除锈实验时,由于忘了及时从稀盐酸中取出已除掉铁锈的铁钉,过了一段时间后,他发现铁钉表面居然出现了黑色物质.通过分析我认为铁钉表面的黑色物质可能是______.
(3)为了探究铁锈除掉后溶液的组成,小牛将生锈的铁钉放入一支试管中,加入一定量的稀盐酸,待铁钉表面的铁锈恰好溶解完时,迅速取出铁钉,再进行以下实验.
我能写出(3)中的一个化学方程式______.
(4)通过以上探究,我获得的启示是______.
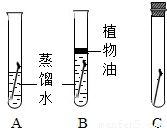
(1)小牛和小明通过如图所示实验对铁制品生锈的条件进行探究.通过观察和分析:
最易生锈的是______(填序号),试管B中加入植物油的目的是______.我得出铁生锈的条件是______.
(2)在实验室用稀盐酸除铁锈的实验中,小牛认为盐酸中含有H2O、H+、Cl-三种粒子,为了探究稀盐酸中哪种粒子能使铁锈溶解,他进行了如下实验,我能帮他完成.
| 实验步骤 | 实验现象 | 实验结论 | 设计实验的目的 |
| 向装有铁钉的试管中加入足量NaCl溶液,振荡 | 铁锈不溶解 | ______ | ______ |
小明在做铁钉除锈实验时,由于忘了及时从稀盐酸中取出已除掉铁锈的铁钉,过了一段时间后,他发现铁钉表面居然出现了黑色物质.通过分析我认为铁钉表面的黑色物质可能是______.
(3)为了探究铁锈除掉后溶液的组成,小牛将生锈的铁钉放入一支试管中,加入一定量的稀盐酸,待铁钉表面的铁锈恰好溶解完时,迅速取出铁钉,再进行以下实验.
| 实验步骤 | 实验现象 | 实验结论 |
| 向装有铁钉的试管中加入过量的铁粉 | ______ | ______ |
(4)通过以上探究,我获得的启示是______.