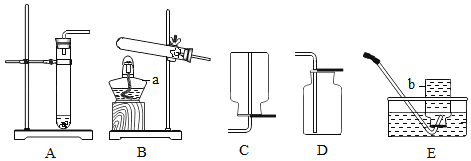
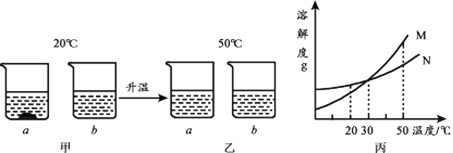
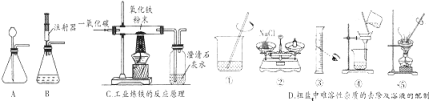
题目内容
【题目】二氧化钛(TiO2)是许多反应的催化剂。工业上用钛铁矿(主要成分为FeTiO3(钛酸亚铁,不溶于水)、Fe2O3及少量SiO2(不与H2SO4反应且不溶于水))作原料,制取二氧化钛及绿矾(FeSO4·7H2O),其生产流程如下:
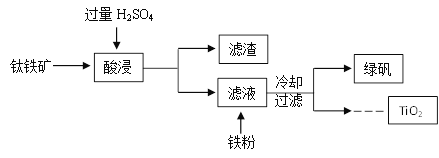
(1)TiO2中钛元素的化合价为__________。
(2)加入铁粉,发生置换反应的化学方程式为__________。
(3)以TiO2为原料还可以制取金属Ti。请将其中的一步反应的化学方程式补充完整:TiO2+2Cl2+C=TiCl4 +__________。
【答案】 + 4 Fe + H2SO4= FeSO4 + H2↑ CO2
【解析】本题是流程题。掌握酸与金属的化学性质、化合物中元素的化合价的代数式和为零,质量守恒定律的应用等是解题的关键。
(1)TiO2中氧元素化合价为-2,设:Ti化合价为x,在化合物中元素的化合价的代数式和为零,则x+(-2)×2=0,解之得x=+4;
(2)加入铁粉,铁粉能与过量的稀硫酸生成硫酸亚铁溶液和氢气,反应的化学方程式为:Fe + H2SO4= FeSO4 + H2↑;
(3)由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式,反应前钛、氧、氯、碳原子个数分别为1、2、4、1,反应后的生成物中钛、氧、氯、碳原子个数分别为1、0、4、0,根据反应前后原子种类、数目不变,横线上物质的分子由2个氧原子和1个碳原子构成,物质X的化学式为CO2。

 阅读快车系列答案
阅读快车系列答案【题目】实验室用碳酸钠溶液与氯化钙溶液反应制取高纯度碳酸钙粉末,烧杯中现有100g碳酸钠溶液,将150g氯化钙溶液分四次加入,充分反应,四次测量所得数据如下表所示:
次数 | 累计加入氯化钙溶液的质量/g | 烧杯中溶液的总质量/g |
一 | 40 | 134 |
二 | 80 | 168 |
三 | 120 | 202 |
四 | 150 | 232 |
(1)恰好完全反应时,生成沉淀的总质量为____g。
(2)第四次测量时,所得溶液中的溶质有_______(填化学式)。
(3)计算氯化钙溶液的溶质质量分数为______________(写出计算过程)。