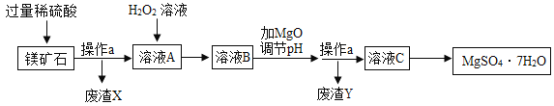
��Ŀ����
����Ŀ������֪ʶ���������ݲ���ȫ��ȷ��һ���ǣ�������
A��ѧ��Ӧ�������� | B��ѧ������ |
�ٻ��Ϸ�ӦC+O2 �ڽⷴӦH2CO3��H2O+CO2�� ���û���ӦC+2CuO �ܸ��ֽⷴӦHCl+AgNO3��AgCl��+HNO3 | ��Һ�����������ڻ������ȼ�� ������ȱ����Ԫ�ة����¼�״���״� �ۼ�����ë�ͺϳ���ά����ȼ������ζ ����ϴ�ྫ��ȥ�;�����һ�����黯���� |
C��ѧʵ�����ݼ�¼ | D��ѧ�г����������� |
��������ƽ��ȡ7.8g���� ��250mL��Ͳ��ȡ47.25mLˮ ����pH��ֽ���ƻ��֭��pHΪ3.2 | ��ú��ʯ�͡���Ȼ��һһ����ʯȼ�� �����ϡ��ϳ���ά���ϳ���������ϳɲ��� �۷��ӡ�ԭ�ӡ�����һһ�������ʵ����ֻ������� |
A. AB. BC. CD. D
���𰸡�C
��������
A���ٸ÷�Ӧ����������������һ�����ʣ����ڻ��Ϸ�Ӧ���ڸ÷�Ӧ����һ�����������������ʣ����ڷֽⷴӦ���۸÷�Ӧ����һ�ֵ�����һ�ֻ����ﷴӦ������һ�ֵ�������һ�ֻ���������û���Ӧ���ܸ÷�Ӧ�������ֻ�����������ɷ������������µĻ�������ڸ��ֽⷴӦ����A����ȷ��
B��������������ȼ�ԣ�����Һ�������ڻ������ȼ����������ȱ����Ԫ�ػᵼ�¼�״���״ۼ�����ë�ͺϳ���ά���ɵ�ȼ������ζ�������ս���ë��ζ������ë������ζ���Ǻϳ���ά������ϴ�ྫ�����黯���ã����Կɳ�ȥ�;����ۣ���B����ȷ��
C����������ƽ��ȷ��0.1g��������ƽ�ܳ�ȡ7.8g���ۣ�����Ͳֻ�ܾ�ȷ��0.1mL��������ȡ47.25mLˮ�������̹�������pH��ֽ��õ���ֵֻ�ܱ�����������ֻ������ȷ����C����ȫ��ȷ��
D����ú��ʯ�͡���Ȼ��������ʯȼ�ϣ������ϡ��ϳ���ά���ϳ���������ϳɲ��ϣ��۷��ӡ�ԭ�ӡ������ǹ������ʵ����ֻ������ӣ���ȫ��ȷ����D����ȷ����ѡC��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��ijУ��ѧ��ȤС��ι��Ƽ���������Ϣ���������������о���
[��������]
������1���ó����á������Ƽ�������Ļ�����ƷΪ�����ѧʽΪ_____�����Ȼ�泥����������Ƽ�����ҹ�����������ѧ�Һ�°�����һ�����������������Ȼ�淋������Ƽ�գ���
������2������ԭ�ϴ����к����������������ʣ�MgCl2��CaCl2�������������ʣ�
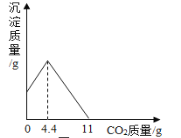
������3������������������ͼ��ʾ��
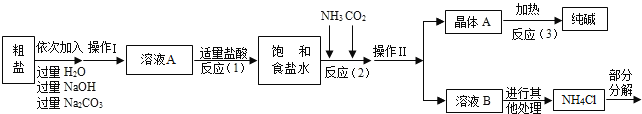
�����������漰�IJ��ַ�Ӧ�Ļ�ѧ����ʽΪ��MgCl2+2NaOH��Mg��OH��2��+2NaCl��Na2CO3+CaCl2��CaCO3��+2NaCl��NH4Cl�TNH3��+HCl��
����ԭ������������NH3���Ͷ�����̼ͨ�뱥��ʳ��ˮ�еõ�С�մ���Ȼ�淋Ļ����䷴Ӧ�Ļ�ѧ����ʽΪ��NaCl��������Һ��+NH3+CO2+H2O��NaHCO3�����壩��+NH4Cl�������NaHCO3��ʹ�������ȼ��ɷֽ��Ƶô�����ֳ�����������˷�Ӧ�Ļ�ѧ����ʽΪ_____��
���������ۣ�
��1����ҺA�е�����Ϊ_____�������������Ϊ_____��
��2���������������п�ѭ��ʹ�õ���_____������ţ���
ACO2BNH3C��HCl DNaOH ENa2CO3
��3������������Ϣ���������ʵ������̼���ƺ�̼�����ƣ�
ʵ�鲽�� | ʵ������ | ʵ����� |
_____ | _____ | _____ |
�������ⶨ��
ͬѧ��Ϊ�˲ⶨ�ô�����Ʒ�Ĵ��ȣ����������ʵ�飮
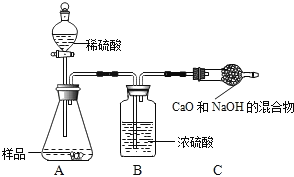
���飺ȡ10.0g������Ʒ���ٶ�����������ʵ������в������仯���������м�����������ᣬֱ����Ʒ��������ð������ּ��������������ʲ������ȴ�����º���������ù�������Ϊ10.9g����Ʒ��̼���Ƶ���������Ϊ_____���������һλС������
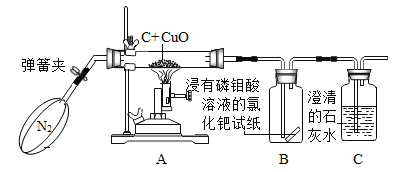
���飺ȡ10.0g������Ʒ��������ͼ��ʾװ�ã������Ӧ��װ��C������3.5g�������Լ�����������
ʵ�������������ⶨ����������ƫС����ԭ����_____��