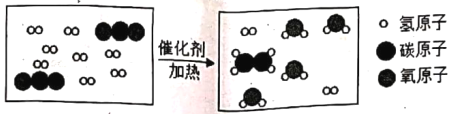
题目内容
【题目】取相对分子质量为46的某有机物4.6g,在足量的氧气中充分燃烧,生成8.8g二氧化碳和5.4g水,据此判断该有机物()
A.其分子中C、H、O原子个数比为2:5: 1
B.其化学式为CH2O2
C.只由碳、氢两种元素组成
D.一定含有碳、氢、氧三种元素
【答案】D
【解析】
根据质量守恒定律可知,一种物质燃烧只生成水和二氧化碳,则该物质肯定含有碳和氢元素,二氧化碳中碳元素、氢元素全部来自该物质。该物质中碳元素质量=![]() ,氢元素质量=
,氢元素质量=![]() ,氧元素质量:4.6g-2.4g-0.6g=1.6g,碳原子、氢原子、氧原子个数比:
,氧元素质量:4.6g-2.4g-0.6g=1.6g,碳原子、氢原子、氧原子个数比:![]() ,因此化学式是
,因此化学式是![]() 。
。
根据以上分析可知:
A、该物质分子中C、H、O原子个数比为2:6: 1,不符合题意;
B、该物质化学式是![]() ,不符合题意;
,不符合题意;
C、该物质由碳元素、氢元素和氧元素组成,不符合题意;
D、该物质由碳元素、氢元素和氧元素组成,符合题意。
故选:D。

 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案【题目】醋是中国传统的调味品,市场上售卖的某一品牌白醋,标签说明,除了3%~5%的醋酸(CH3COOH)和水之外不含或极少含其他成分,请回答相应问题。
(1)白醋是____________(填“纯净物”或“混合物”),醋酸分子中氢、氧原子个数比为_____________。
(2)酿醋原理是在醋酸菌作用下乙醇(CH3CH2OH)与氧气反应,除生成醋酸外,还有另一产物,请写出该反应的化学方程式________________。
(3)某同学对白醋的性质进行如下探究。
实验操作 | 实验现象 | 实验结论与解释 |
①向白醋中滴入______ | 观察到溶液变红 | 白醋显酸性 |
②向镁粉中滴加白醋直至过量 | __________________ | 白醋能与活泼金属反应 |
③将白醋滴加到碳酸钙表面 | 有少量气泡产生 | 反应的化学方程式是_________ |
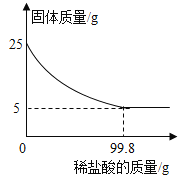
(4)若用如图装置验证水和二氧化碳两种气体生成物,应将生成的混合气体先通过_________装置,反之会有何影响?_______________。若将气体通入装置A进行验证时,气流应从_______________口通入。
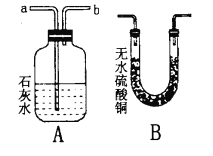
【题目】水及溶液与人类的生活生产密切相关。根据下列图示,请回答相关问题。
图1活性炭净水器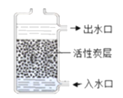 图2 水的电解
图2 水的电解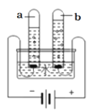
图3 溶解度曲线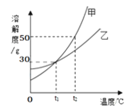 图4 探究实验
图4 探究实验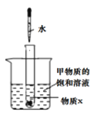
(1)图1中,活性炭净水器主要利用了活性炭具有的____性;图2所示实验中,试管b中得到的气体是(写物质名称)____。
(2)图3为甲、乙两种固体物质的溶解度曲线图。t1℃时,甲物质的溶解度是__,t2℃时,甲的饱和溶液溶质质量分数_________乙的饱和溶液溶质质量分数(填“大于”、“等于”、“小于”之一);图4所示实验中,将水滴入盛有物质X的小试管中,可观察到烧杯中有甲物质的固体析出。则物质X可能是_________(填序号之一)。
A 食盐 B 烧碱 C 生石灰 D 硝酸铵
(3)下图是氯化钠和硝酸钾在不同温度的溶解度,请回答。
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 | |
①20℃时,将136g饱和NaCl溶液蒸发10g水后,再降温到20℃,可析出NaCl晶体的质量为____;
②某小组想用20%的氯化钠溶液(密度为1.17g/cm3),配制30g质量分数为10%的氯化钠溶液,需要20%的氯化钠溶液____mL
③若将上表数据在坐标系中绘制成NaCl和KNO3的溶解度曲线,两条曲线的交点对应的温度范围是___(填序号)。
A 0~20℃ B 20~40℃ C 40~60℃ D 60~80℃