题目内容
【题目】培养学生实验探究与创新意识是化学学科素养任务之一。某校化学兴趣小组的同学在老师的指导下,对某铝合金粉末中铁、铜的存在情况进行了探究。
(查阅资料)铝能与氢氧化钠溶液发生反应,方程式为![]()
(产物![]() 溶于水);
溶于水);![]() 、
、![]() 均不与氢氧化钠溶液反应。
均不与氢氧化钠溶液反应。
(猜想)猜想1:该合金粉末中除铝外,还含有铁
猜想2:该合金粉末中除铝外,还含有__________(填名称)
猜想3:该合金粉末中除铝外,还含有铁、铜
(实验探究)下列实验仅供选择的试剂:稀盐酸、![]() 溶液
溶液
实验方案 | 实现现象 | 结论 |
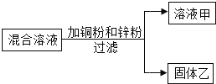
①取一定量的合金粉末,加过量的__________,充分反应后过滤,滤渣备用。 | 粉末部分溶解,并有气泡产生。 | 该合金中一定含有__________。 |
②取步骤①所得滤渣,加过量的__________,充分反应 | 滤渣部分溶解,并有气泡产生,溶液由无色变为浅绿色。 | 该合金中一定含有__________。 |
(探究结论)__________。
(反思)一般来说,活泼金属能与盐酸等酸反应,而铝与酸、碱都能反应,说明铝具有特殊的性质。铝在空气中也具有耐腐蚀的性质,写出铝在空气中耐腐蚀原因的化学反应方程式__________。
【答案】铜 ![]() 溶液 铝 稀盐酸 铁、铜 猜想3成立
溶液 铝 稀盐酸 铁、铜 猜想3成立 ![]()
【解析】
[猜想]
猜想1:该合金粉末中除铝外,还含有铁。
猜想2:该合金粉末中除铝外,还含有铜。
猜想3:该合金粉末中除铝外,还含有铁、铜。
故填:铜。
[实验探究]
①取一定量的合金粉末,加过量的氢氧化钠溶液,充分反应后过滤,粉末部分溶解,并有气体放出,是因为铝和氢氧化钠反应生成了氢气;
②取步骤①所得滤渣,加过量的稀盐酸,充分反应,滤渣部分溶解,并有气体放出,溶液呈浅绿色,是因为铜不能和盐酸反应,铁能和盐酸反应生成氯化亚铁和氢气,实验过程如下所示:
实验方案 | 实现现象 | 结论 |
①取一定量的合金粉末,加过量的氢氧化钠溶液,充分反应后过滤,滤渣备用。 | 粉末部分溶解,并有气体放出。 | 合金中一定含有铝。 |
②取步骤①所得滤渣,加过量的稀盐酸,充分反应。 | 滤渣部分溶解,并有气体放出,溶液呈浅绿色。 | 合金中一定含有铁、铜。 |
[探究结论]由以上结论可知,猜想3成立。
[反思]
通常情况下铝能和空气中的氧气反应生成氧化铝,反应的化学方程式为:4Al+3O2═2Al2O3。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案