题目内容
【题目】兴趣小组对“一氧化碳还原氧化铁”的实验进行拓展研究。
(查阅资料)I.碳酸镁和锌能发生如下反应MgCO3+Zn![]() MgO+ZnO+CO↑
MgO+ZnO+CO↑
Ⅱ.氯化亚铜的氨水溶液能和CO反应,产生红色固体
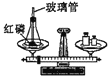
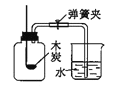
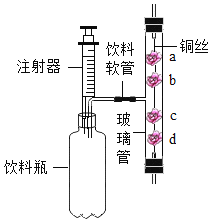
(设计方案)根据上述资料设计如图实验装置(固定装置略,装置气密性良好):
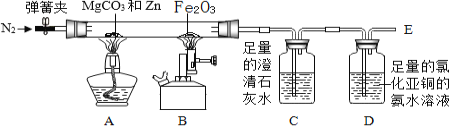
(实验步骤)①打开弹簧夹,通入适量氮气;②关闭弹簧夹,点燃A处酒精灯、B处酒精喷灯;③观察实验现象;④熄灭酒精灯和酒精喷灯。
(实验分析)(1)步骤①的目的是______;
(2)步骤③中,B处玻璃管内反应的化学方程式为_______,D装置的作用是_______。
(3)工业炼铁的产品为生铁,将5.8克生铁与94.6克稀盐酸恰好完全反应(杂质不溶于水,不与酸反应),烧杯中剩余物总质量为100.2克,求:①生成氢气的质量______;②反应后所得溶液中溶质的质量分数______。(精确到0.1%)
【答案】排尽空气 0.2g 吸收CO,防止污染或处理尾气或检验CO 0.2g 12.7%
【解析】
(1)根据一氧化碳具有可燃性,一氧化碳和氧气的混合气点燃可能发生爆炸进行分析;
(2)根据一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳,以及一氧化碳的性质来分析;
(3)加入样品5.8g和94.6g稀盐酸,最后得到100.2g物质,质量减少了,这是生成的氢气的质量,根据质量守恒定律可得氢气的质量;从而进一步求算硫酸亚铁的质量,最后根据溶液的质量求算所得氯化亚铁的质量分数。
(1)一氧化碳具有可燃性,一氧化碳和氧气的混合气点燃可能发生爆炸,所以步骤①的目的是:排尽装置内的空气,防止加热混合气体引起爆炸;
(2)一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳,化学方程式为:Fe2O3+3CO![]() 2Fe+3CO2,因为氯化亚铜的氨水溶液能和CO反应,所以D装置的作用是吸收CO,防止污染或处理尾气;
2Fe+3CO2,因为氯化亚铜的氨水溶液能和CO反应,所以D装置的作用是吸收CO,防止污染或处理尾气;
(3)依据质量守恒定律可知生成的氢气的质量是:5.8g+94.6g-100.2g=0.2g;
设生成FeCl2质量为x,
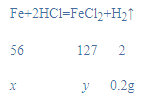
![]() x=5.6g,
x=5.6g,
![]() y=12.7g,
y=12.7g,
反应后所得溶液中溶质的质量分数=![]() ×100%=12.7%。
×100%=12.7%。

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案【题目】学校研究性学习小组为了测定当地矿山石灰石中碳酸钙的质量分数,取来了一些矿石样品,并取稀盐酸200 g,平均分成4份进行实验,结果如下:
实 验 | 一 | 二 | 三 | 四 |
加入样品的质量/g | 5 | 10 | 15 | 20 |
生成CO2的质量/g | 1.76 | 3.52 | 4.4 | m |
(1)上表中m的数值是________;
(2)反应中矿石有剩余是第_______次实验;
(3)这种石灰石矿中碳酸钙的相对分子质量是_______;
(4)15g碳酸钙中各元素质量比是_______;
(5)求稀盐酸中溶质的质量分数____。(写出计算过程)