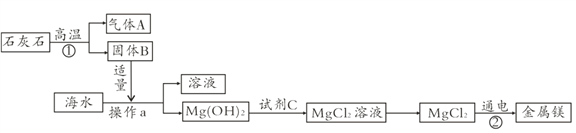
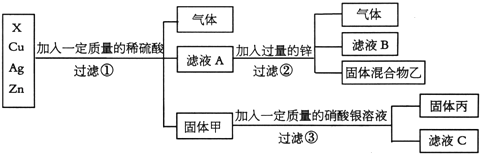
题目内容
【题目】高纯氧化铁可作现代电子工业的材料。以下是以硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2)为原料制备高纯氧化铁(Fe2O3)的生产流程图。
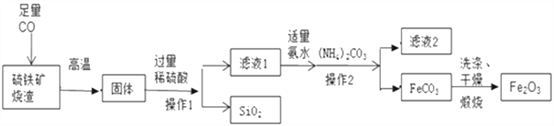
(1)实验室中,操作1、操作2用到的玻璃仪器有玻璃棒、烧杯、_____等。
(2)滤液1中主要的阳离子是 ______________。(写2种)
(3)滤液1中加氨水要适量,若氨水不足,则硫酸不能完全反应;若氨水过量,则__________________。
(4)滤液2中可回收的产品是____________(写化学式)。
(5)写出在空气中煅烧FeCO3的化学反应方程式______________________________
【答案】 漏斗 Fe2+、H+ 会生成Fe(OH)2(或Fe(OH)3) (NH4)2SO4 4FeCO3+O2![]() 2Fe2O3+4CO2
2Fe2O3+4CO2
【解析】(1)据图可以看出,经过操作Ⅰ、操作Ⅱ得到的是滤液和固体,故是过滤操作,用到的玻璃仪器有玻璃棒、烧杯、漏斗;
(2)一氧化碳能将氧化铁还原为铁,将氧化亚铁还原为铁,故硫铁矿高温通入一氧化碳得到的固体中主要含有的是铁,稀硫酸能与铁反应生成硫酸亚铁和氢气,故含有亚铁离子,由于硫酸过量,故含有氢离子,滤液Ⅰ中主要的阳离子是亚铁离子和氢离子,化学符号为:Fe2+、H+;
(3)由于硫酸过量,溶液呈酸性,氨水呈碱性,若氨水过量,会生成Fe(OH)2或Fe(OH)3;
(4)碳酸铵能与硫酸亚铁反应生成碳酸亚铁和硫酸铵,故滤液Ⅱ中可回收的产品是硫酸铵,化学式为:(NH4)2SO4;
(5)在空气中煅烧FeCO3生成氧化铁和二氧化碳,反应的化学方程式是:4FeCO3+O2![]() 2Fe2O3+4CO2。
2Fe2O3+4CO2。

 口算能手系列答案
口算能手系列答案【题目】订书钉是生活中常用文具,顾老师指导同学们围绕订书们钉开展实验研究。
实验步骤 | 实验内容 |
① | 用磁铁吸引订书钉,发现订书钉能被吸引 |
② | 取一个订书钉块(40根钉子)(如图甲所示),浸入酒精中,一段时间后能从订书钉块上取下一层胶水薄膜 |
③ | 取上述订书钉块用棉花擦去精,并待酒精完全挥发后称量其质量为13.4g |
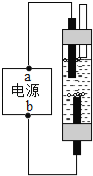
④ | 将其放入图乙所示装置,并在干管口用氢气传感器测量氢气质量,同时记录质量变化 (如图丙所示) |
⑤ | 5.8分钟时停止反应取出装置剩余订书钉,洗涤、干操、称量,剩余订书钉质量为7.8g |
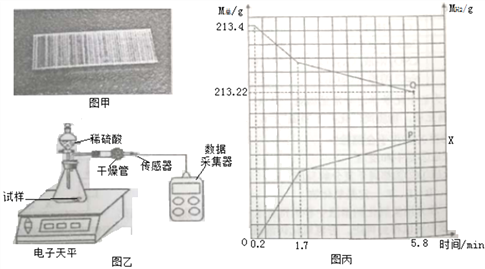
问题思考:
(1)订书钉表面涂胶水的目的主要是_______________;
(2)查阅资料可知:订书钉主要成分为铁,并在其表面镀一种金属。请结合图丙分析:
①图丙中P点纵坐标X的值_______________________;
②0→0.2分钟不产生氢气的原因主要是______________;
③请写出1.7分钟后装置中发生的主要化学反应方程式____________;
④订书钉表面镀的金属可能是钙、镁、铝、锌、铜中的一种,请根据实验分析该金属是_______。