题目内容
【题目】物质都是由微观粒子构成的。在构成下列四种物质的微粒示意图中, “○”和“![]() ”分别表示氢和氧两种元素的原子。
”分别表示氢和氧两种元素的原子。
物 质 | 甲 | 乙 | 丙 | 丁 |
构成该物质的粒子 |
|
|
|
|
(1)四种物质中,属于单质的是__________(填物质代号,下同)。
(2)四种物质中,不同种元素原子个数比为1:1的是___________,含有H2分子的是___________。
(3)甲物质在一定条件下反应可生成丙,该反应的化学方程式为______________,该反应属于________反应(填“化合”或“分解”)。
【答案】丙丁 甲 丁 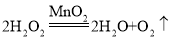 分解
分解
【解析】
(1)根据宏观上单质由同种元素组成,微观上由同种原子构成可知:丙丁(O2、H2)是单质;
(2)根据四种物质的化学式分别是H2O2、H2O、O2、H2可知:不同种元素原子个数比为1:1的是H2O2,含有氢气分子的是氢气的单质;
(3)双氧水分解可生成水与氧气,该反应的化学方程式为: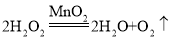 ;该反应的特点是“一变多”符合分解反应的特征。
;该反应的特点是“一变多”符合分解反应的特征。

【题目】中和反应是一类重要的化学反应:
①能与稀硫酸发生中和反应的_____________
A 氢氢化钡 B 碳酸钠 C 镁带 D 氧化铜
②小组同学将氢氧化钠溶液和稀盐酸混合反应。实验装置如图,采用无色酚酞试液作酸碱指示剂,用传感器分别测定溶液pH、溶液温度的变化情况。请写出该中和反应的化学方程式:____________。根据表格数据回答:

滴加液体的体积(毫升) | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
pH | 13.1 | 12.8 | 12.3 | 11.5 | 10.4 | 7.0 | 2.7 | 2.3 | 2.2 | 2.1 | 2.0 |
温度(℃) | 25.5 | 25.8 | 26.1 | 26.4 | 26.8 | 27.0 | 26.9 | 26.8 | 26.7 | 26.6 | 26.6 |
③混合前,烧杯内的是_______________溶液,判断的依据是________。
④当滴加液体体积为________________mL时,酸碱中和反应恰好完成。根据表格数据可判断;中和反应是____________(填“吸热”“放热”或“无变化”)的反应,理由是__________
⑤当滴加液体6mL时,烧杯中的溶质(除酚酞以外)有________(填化学式);若酚酞无色则滴加液体的体积可能是___________mL
A 4 B 8 C 10 D 14
⑥有同学发现在实验过程中,开始时没有气泡,持续滴加液体后,观察到有气泡产生,请分析可能的原因________,并设计实验证明你的结论________________
⑦现有两杯质量相同、溶质质量分数相同的NaOH溶液和KOH溶液,在NaOH溶液中加入xg盐酸恰好中和;在KOH溶液中加入yg上述盐酸也能恰好中和,则x____________y
A > B < C = D 无法判断
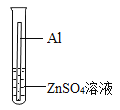
【题目】某化学兴趣小组同学以“比较铝和锌的金属活动性强弱”为课题进行探究,下面是小华同学和小明同学探究的主要过程:
(提出问题)铝和锌两种金属,哪一种金属活动性更强?
(实验原理)小华同学利用常温下两种金属与酸反应,测定收集等体积氢气所需的时间,判断金属活动性强弱;小明同学利用金属与盐溶液的反应比较金属活动性强弱。
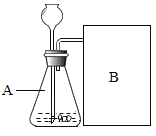
(进行实验)
实验一:上图是小华的实验装置图,实验中B处宜采用的气体收集方法是________。
实验编号 | 实验1 | 实验2 |
金属 | 1g表面未氧化的锌粒 | 1g表面打磨过的铝片 |
酸溶液 | 10mL10%的稀盐酸溶液 | 10mL10%的稀硫酸溶液 |
收集20mL氢气所需的时间 | 42s | 64s |
实验结论 | 根据实验现象,得出Zn____Al(填“>” “<”或“=” | |
实验二:小明的实验方案
实验步骤 | 实验现象 | 实验结论 |
将表面打磨过的铝片插入硫酸锌溶液中
| ______ | 金属活动性:Al>Zn |
(分析与评价)
①写出铝与硫酸锌溶液反应的化学方程式_____________;
②两位同学的实验结论刚好相反,你判断______同学实验结论错误,理由是__________。
(实验延伸)为了研究金属与酸反应的其他影响因素,小明用纯锌和纯度为90%的粗锌在相同条件下反应,发现粗锌反应速率更快。
(查阅资料)粗锌中含有铜等与酸不反应的杂质
(猜想与假设)造成粗锌反应速率更快的原因可能是___________。
(设计实验)请设计合理的实验方案验证你的猜想。
实验步骤 | 实验可能的现象及结论 |
__________ | ___________ |
【题目】某实验小组同学用加热氯酸钾制取一定量的氧气,取一定质量的氯酸钾与二氧化锰混合,其总质量为6g。依次加热该混合物t1、t2、t3、t4时间后,分别冷却称量剩余固体质量,记录的有关数据如下表(已知参加化学反应的各物质的质量之和等于反应后生成的各物质的质量之和):
加热时间 | t1 | t2 | t3 | t4 |
剩余固体质量(g) | 4.24 | 4.16 | 4.08 | 4.08 |
(1)写出加热氯酸钾制取氧气的文字表达式_________________。
(2)试计算完全反应后产生的氧气的总质量_______ g。(不写计算过程)