��Ŀ����
����Ŀ����֪NaHCO3��270��ʱ��ȫ�ֽ�Ϊ̼���ơ�ˮ�Ͷ�����̼����Na2CO3���Ȳ��ֽ⣮����ij������������һ��NaHCO3��Ʒ�л���������Na2CO3 �� ij��ȤС��ͬѧΪ�˲ⶨ�ò�Ʒ��NaHCO3�������������������������ʵ�鷽����
����һ����Ʒ�м���Ū����ⶨ����CO2��������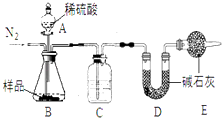
��1����ʵ�������ͼ��ʾ��װ�ã�C��ʢ�ŵ������� ��
��2�����ѷ�Һ©���е�ϡ�����Ϊϡ���ᣬ������������ȷ������£�����ܡ����ܡ���ȷ�ⶨ��Ʒ��NaHCO3������������
����������Ʒ ![]() �ⶨʣ�����������
�ⶨʣ�����������
��������������£�
��һֻ�ྻ���������Ƶ�����Ϊ21.2�ˣ��������м�����Ʒ���Ƶ�������Ϊ41.2�ˣ�
�ڼ���ʢ����Ʒ��������
�۽����������ȴ������������ʣ������������
�ܶ���ظ�����ں͢������أ��Ƶ�������ʣ������������Ϊ35.0�ˣ�
��3��ʵ��ʱ��Ҫ�ظ������ȡ���ȴ��������������Σ���Ŀ���� ��
��4���������⣬������Ʒ��NaHCO3������������д��������̣�
����֪2NaHCO3 ![]() Na2CO3+H2O+CO2����
Na2CO3+H2O+CO2����
���𰸡�
��1��Ũ����
��2������
��3��ʹ̼�����ƹ�����ȫ�ֽ�
��4���⣺ʵ������м��ٵ�������ˮ�Ͷ�����̼�������������������Ϊ��41.2g��35g=6.2g��
����Ʒ�к���̼������Ϊx��
2NaHCO3 | ������� |
168 | 62 |
x | 6.2g |
![]()
x=16.8g
��Ʒ��̼������Ϊ��41.2g��21.2g=20g
������Ʒ��NaHCO3����������Ϊ�� 16.8 g 20 g ��100%=84%��
����������1����ʯ�һ�����ˮ�ֺͶ�����̼��ʵ�����ü�ʯ�����ն�����̼֮ǰ����Ҫ��������C��ʢ�ŵ�������Ũ�����2����ʯ���Ǽ��Ը������������лӷ��ԣ���������������Ӱ�죬���Բ���ȷ�ⶨ��Ʒ��NaHCO3��������������3��ʵ��ʱ��Ҫ�ظ������ȡ���ȴ��������������Σ�����ʹ̼��������ȫ�ֽ⣻��4��ʵ������м��ٵ�������ˮ�Ͷ�����̼�������������������Ϊ��41.2g��35g=6.2g��
����Ʒ�к���̼������Ϊx��
2NaHCO3 | ������� |
168 | 62 |
x | 6.2g |
![]()
x=16.8g
��Ʒ��̼������Ϊ��41.2g��21.2g=20g
������Ʒ��NaHCO3����������Ϊ�� ![]() ��100%=84%��
��100%=84%��
���Դ��ǣ�Ũ������ܣ�ʹ̼�����ƹ�����ȫ�ֽ⣻
�⣺ʵ������м��ٵ�������ˮ�Ͷ�����̼�������������������Ϊ��41.2g��35g=6.2g��
����Ʒ�к���̼������Ϊx��
2NaHCO3 | ������� |
168 | 62 |
x | 6.2g |
![]()
x=16.8g
��Ʒ��̼������Ϊ��41.2g��21.2g=20g
������Ʒ��NaHCO3����������Ϊ�� 16.8 g 20 g
��100%=84%��
�����㾫����ͨ��������ø��ݻ�ѧ��Ӧ����ʽ�ļ��㣬���ո����ʼ�������=ϵ������Է�������֮�ȼ����Խ����⣮

 ����С״Ԫ��������������ϵ�д�
����С״Ԫ��������������ϵ�д�