题目内容
29、(1)钢铁是重要的金属材料,应用十分广泛.
①生铁和钢都属于
②铁在空气中容易锈蚀,实际上是铁跟空气中的
(2)利用金属的性质回答下列问题.
①在相同条件下,把金属M及另外三种金属分别加入到质量和浓度均相等的足量稀硫酸中,通过观察产生气泡的快慢,判断反应的剧烈程度,并记录如下(产生气泡的快慢用“+”表示,“+”越多,表示产生气泡越快).

如果上述金属分别是Al、Mg、Zn、Fe四种中的一种,你认为金属M最有可能是
②氯化铁能腐蚀铜,工业上常用此原理生产印刷线路板.以下是印刷线路板的生产及废液处理过程:(其中镀铜电路板为表面上覆盖一层金属铜的线路板)
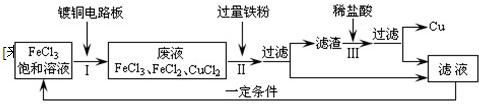
步骤Ⅱ中发生了两个反应的化学方程式分别为:2FeCl3+Fe=3FeCl2和
①生铁和钢都属于
BD
(填字母序号).A.纯净物B.混合物C.金属单质D.合金②铁在空气中容易锈蚀,实际上是铁跟空气中的
氧气和水
共同作用的结果.(2)利用金属的性质回答下列问题.
①在相同条件下,把金属M及另外三种金属分别加入到质量和浓度均相等的足量稀硫酸中,通过观察产生气泡的快慢,判断反应的剧烈程度,并记录如下(产生气泡的快慢用“+”表示,“+”越多,表示产生气泡越快).

如果上述金属分别是Al、Mg、Zn、Fe四种中的一种,你认为金属M最有可能是
Zn
.②氯化铁能腐蚀铜,工业上常用此原理生产印刷线路板.以下是印刷线路板的生产及废液处理过程:(其中镀铜电路板为表面上覆盖一层金属铜的线路板)

步骤Ⅱ中发生了两个反应的化学方程式分别为:2FeCl3+Fe=3FeCl2和
Fe+CuCl2=FeCl2+Cu
;步骤Ⅲ中反应的化学方程式为Fe+2HCl=FeCl2+H2↑
;试写出步骤Ⅰ中氯化铁跟铜反应的化学方程式2FeCl3+Cu=2FeCl2+CuCl2
.分析:(1)①根据钢铁的组成,判断钢铁的分类;②根据对铁生锈的认识,说出铁生锈所应满足的条件;
(2)①由实验现象推断在四种金属中金属M与其它三种金属活动性的关系,判断M在Al、Mg、Zn、Fe四种金属可能是哪种金属;
②分析流程图中各步所发生的反应,写出反应的化学方程式.
(2)①由实验现象推断在四种金属中金属M与其它三种金属活动性的关系,判断M在Al、Mg、Zn、Fe四种金属可能是哪种金属;
②分析流程图中各步所发生的反应,写出反应的化学方程式.
解答:解:(1)①生铁和钢都是铁与碳形成的合金,因此它们都属于混合物;
②铁生锈需要满足铁同时与氧气和水接触;
(2)①根据实验记录中产生氢气的快慢,可知四种金属的活动性强弱关系为金属1>金属2>金属M>金属3;根据金属活动性顺序,Al、Mg、Zn、Fe四种金属活动性强弱关系为Mg>Al>Zn>Fe,对比两组金属的活动性强弱关系,可判断金属M可能为金属锌;
②步骤II中加入过量的铁粉还与溶液中氯化铜发生反应,生成铜和氯化亚铁,化学方程式为Fe+CuCl2=FeCl2+Cu;步骤III中加入稀盐酸以除去混在铜粉中的铁粉,反应的化学方程式为Fe+2HCl=FeCl2+H2↑;根据步骤I后溶液中的溶质,可判断氯化铁与铜反应生成氯化铜和氯化亚铁,化学方程式为2FeCl3+Cu=2FeCl2+CuCl2;
故答案为:
(1)①BD;②氧气和水;
(2)①Zn;②Fe+CuCl2=FeCl2+Cu;Fe+2HCl=FeCl2+H2↑;2FeCl3+Cu=2FeCl2+CuCl2.
②铁生锈需要满足铁同时与氧气和水接触;
(2)①根据实验记录中产生氢气的快慢,可知四种金属的活动性强弱关系为金属1>金属2>金属M>金属3;根据金属活动性顺序,Al、Mg、Zn、Fe四种金属活动性强弱关系为Mg>Al>Zn>Fe,对比两组金属的活动性强弱关系,可判断金属M可能为金属锌;
②步骤II中加入过量的铁粉还与溶液中氯化铜发生反应,生成铜和氯化亚铁,化学方程式为Fe+CuCl2=FeCl2+Cu;步骤III中加入稀盐酸以除去混在铜粉中的铁粉,反应的化学方程式为Fe+2HCl=FeCl2+H2↑;根据步骤I后溶液中的溶质,可判断氯化铁与铜反应生成氯化铜和氯化亚铁,化学方程式为2FeCl3+Cu=2FeCl2+CuCl2;
故答案为:
(1)①BD;②氧气和水;
(2)①Zn;②Fe+CuCl2=FeCl2+Cu;Fe+2HCl=FeCl2+H2↑;2FeCl3+Cu=2FeCl2+CuCl2.
点评:通过对实验结果、实验流程图的分析,获得对问题的判断,体现运用基础知识分析问题的能力.

练习册系列答案
相关题目
 (2013?南通一模)化学不仅与公民的日常生活密切相关,也是材料科学、生命科学和能源科学等现代科学技术的重要基础.
(2013?南通一模)化学不仅与公民的日常生活密切相关,也是材料科学、生命科学和能源科学等现代科学技术的重要基础. (2012?和平区一模)钢铁是重要的金属材料.
(2012?和平区一模)钢铁是重要的金属材料. 钢铁是重要的金属材料.
钢铁是重要的金属材料. 化学不仅与公民的日常生活密切相关,也是材料科学、生命科学和能源科学等现代科学技术的重要基础.
化学不仅与公民的日常生活密切相关,也是材料科学、生命科学和能源科学等现代科学技术的重要基础.