题目内容
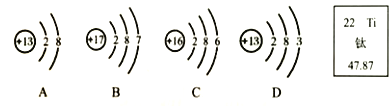
【题目】A、B、C、D是初中化学常见物质,如图是包含A、B、C、D和盐酸5种物质的化学拼图,相邻两张卡片所标的物质间能发生反应。

(1)单质A不可能是_____(填序号);
A Mg B Fe C Ag D Zn
(2)若B为铁锈的主要成分,B与盐酸反应的基本类型是_____;
(3)若C为碳酸钠:①C与D反应的化学方程式为_____,②将二氧化碳通入C溶液,可化合生成碳酸氢钠( NaHCO3),该反应的反应物有_____种。
【答案】C 复分解反应 Na2CO3+Ca(OH)2=CaCO3↓+2NaOH 3
【解析】
(1)由金属活动性顺序可知,排在氢前面的金属可以将酸中的氢置换出来,所以铁、镁、锌会与盐酸反应,Ag不会与盐酸反应,故选:C。
(2)铁锈的主要成分为氧化铁,氧化铁和盐酸反应生成氯化铁和水,化学方程式为:6HCl+Fe2O3═2FeCl3+3H2O,由两种化合物互相交换成分生成另外两种化合物的反应是复分解反应,且生成物中有水,符合复分解反应条件,故填:复分解反应。
(3)碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,化学方程式为:Ca(OH)2 +Na2CO3═CaCO3↓+2NaOH;因为二氧化碳、水和碳酸钠可发生化学反应生成碳酸氢钠, Na2CO3+CO2+H2O=2NaHCO3,故该反应的反应物有3种。
故答案为:(1)C;(2)复分解反应;(3)Ca(OH)2 +Na2CO3═CaCO3↓+2NaOH,3。

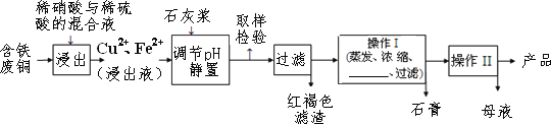
【题目】硫酸铜是一种应用极其广泛的化工原料,易溶于水而不易溶于酒精;以下是某工厂用含铁废铜为原料生产胆矾(CuSO4·5H 2O)和副产物石膏(CaSO4·2H 2O)的生产流程示意图:
胆矾和石膏在不同温度下的溶解度(g/100g 水)如表。
温度(℃) | 20 | 40 | 60 | 80 | 100 |
石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
请回答下列问题:
(1)红褐色滤渣的主要成分是_________;
(2)含铁的废铜和稀硫酸反应的化学方程式_____
(3)操作 I 最后温度应该控制在_____℃左右;
(4)从溶液中分离出硫酸铜晶体的操作Ⅱ应为蒸发浓缩、_____、过滤、洗涤、干燥;晶体用无水乙醇作洗涤液而不用蒸馏水的原因是_____。