题目内容
【题目】(1)若用98%的浓硫酸(密度为1.84g/mL)配制500g19.6%的稀硫酸,需要浓硫酸_____mL(结果精确到0.1)。
(2)向100g碳酸钠溶液中慢慢滴加(1)中配制的稀硫酸,并用玻璃棒不断搅拌,测得pH的变化情况如图。玻璃棒的作用是_____,B处溶液中的溶质有_____。
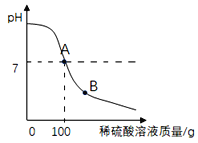
当稀硫酸和碳酸钠溶液恰好完全反应时,求所得溶液中溶质的质量分数。_____(写出详细计算过程,结果精确到0.1%)
【答案】54.3 使反应物充分接触并反应;使反应更充分;使反应更快(合理即可) Na2SO4、H2SO4 14.9%
【解析】
(1)溶液稀释过程中溶质的质量相等,用98%的浓硫酸(密度为1.84g/mL)配制500g19.6%的稀硫酸,设需要浓硫酸的体积是x,则x×1.84g/mL×98%=500g×19.6%,解得x≈54.3mL
(2)向100g碳酸钠溶液中慢慢滴加(1)中配制的稀硫酸,并用玻璃棒不断搅拌,测得pH的变化情况如图。玻璃棒的作用是使反应物充分接触并反应,B处溶液显酸性,则稀硫酸有剩余,溶液中的溶质有生成的Na2SO4、剩余的H2SO4。当稀硫酸和碳酸钠溶液恰好完全反应时,所得溶液是硫酸钠溶液,设所得溶液中溶质的质量是y,生成二氧化碳的质量是z。
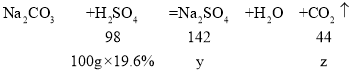
![]() ,解得y=28.4g
,解得y=28.4g
![]() ,解得z=8.8g
,解得z=8.8g
反应后所得溶液的质量为:100g+100g-8.8g=191.2g
所得溶液中溶质的质量分数为:![]() ×100%≈14.9%
×100%≈14.9%

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目