题目内容
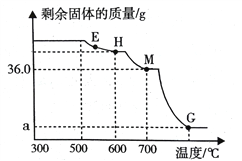
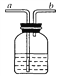
【题目】向盛有10g49%稀硫酸的烧杯中加入5.6g克的铁粉,充分反应后有固体残留,t1时迅速倒入一定量的硫酸铜溶液.整个过程烧杯中溶液的质量随时间的变化如下图所示.下列说法正确的是
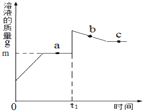
A. 取a点时溶液,加入锌粉,有气体放出 B. b点时,溶液中溶质有两种.
C. c点时,烧杯中固体一定是铜 D. m =12.7
【答案】BD
【解析】A、充分反应后有固体残留,说明铁过量,稀硫酸已被反应完,取a点时溶液,加入锌粉,不会有气体放出,错误;B、t1时迅速倒入一定量的硫酸铜溶液,剩余的铁粉会和硫酸铜溶液反应生成硫酸亚铁和铜,由化学反应方程式Fe+CuSO4==Cu+FeSO4
56 64
根据质量守恒定律可知,溶液的质量减小,所以b点时仍然还有硫酸铜溶液,所以b点时溶液中的溶质为硫酸亚铁和硫酸铜,正确;
C、c点时,若铁粉过量,烧杯中固体就是铁和铜,若倒入的硫酸铜过量,固体则为铜,错误;D、设硫酸完全反应是生成氢气的质量为![]() ,参加反应的铁的质量为y,Fe+H2SO4==FeSO4+H2↑
,参加反应的铁的质量为y,Fe+H2SO4==FeSO4+H2↑
56 98 2
y 10![]() 49%
49% ![]()
![]() ,
, ![]() =0.1g,y=2.8g。所以溶液的质量为10g+2.8g-0.1g=12.7g。故选BD。
=0.1g,y=2.8g。所以溶液的质量为10g+2.8g-0.1g=12.7g。故选BD。

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目