题目内容
【题目】酸雨,对自然界的危害较大,污染较为严重,主要是因为大量燃烧含硫量高的煤而形成的,此外,各种机动车排放的尾气也是形成酸雨的重要原因。
(提出问题)通过实验证明煤中含有碳元素和硫元素。
(查阅资料)(1)“二氧化硫能使高锰酸钾溶液褪色(由紫红色变为无色),该反应的化学方程式为:5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2X ”。这个化学方程式中最后一种物质X的化学式是:______。
(2)“二氧化硫和二氧化碳一样,也能使澄清石灰水变浑浊。”
根据上述资料,甲同学、乙同学和丙同学分别设计实验方案进行探究。
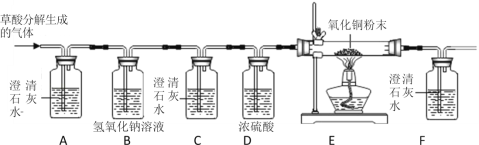
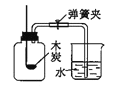
(实验探究一)甲同学进行了如下图所示A、B两步实验:

甲同学观察到:A中_____________, B中澄清石灰水变浑浊。
于是“得出结论”:煤燃烧生成二氧化硫和二氧化碳,证明煤中含有碳元素和硫元素。
(3)乙同学认为甲同学的实验方案有不合理之处,理由是_________。
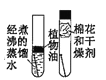
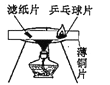
(实验探究二)丙同学进行了如下图所示实验(部分装置在图中略去):
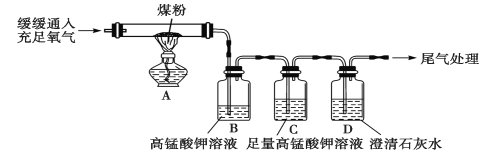
(探究与结论)(4)上图C装置的作用是__________。
(5)丙同学的实验中要证明煤中含有碳元素和硫元素的现象是_________。
(反思)(6)为了防止减少酸雨的危害,我们应该怎么做?(写一点即可)________。
【答案】H2SO4 高锰酸钾溶液褪色 二氧化硫也能使石灰水变浑浊 充分吸收SO2 B中溶液褪色,C中溶液不褪色,D中溶液变浑浊 对煤和石油进行脱媒处理或清洁能源
【解析】
(1)根据反应的化学方程式5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2X及质量守恒定律(反应前后各原子种类和数目不变)判断:反应前5SO2、2KMnO4、2H2O中共含有5个硫原子、2个钾原子、2个锰原子、20个氧原子、4个氢原子,反应后K2SO4、2MnSO4中共含有3个硫原子、2个钾原子、2个锰原子、12个氧原子、0个氢原子,2X中应含有4个氢原子、2个硫原子、8个氧原子;一个X分子中应含有2个氢原子、1个硫原子、4个氧原子,所以这个化学方程式中最后一种物质X的化学式是H2SO4;
(2)根据结论:煤燃烧生成二氧化硫和二氧化碳,二氧化硫具有强氧化性,能使高锰酸钾溶液褪色;可观察到A中高锰酸钾溶液褪色;
(3)由于二氧化硫也能使石灰水变浑浊,所以不能判断含有碳元素;
(4)因为二氧化硫能使高锰酸钾溶液褪色(由紫红色变为无色),所以C装置的作用是充分吸收SO2;
(5)二氧化硫的检验用品红,二氧化硫会使之褪色,二氧化碳检验用澄清石灰水,检验二氧化碳之前先检验二氧化硫,再将之除尽,最后检验二氧化碳,二氧化碳能使石灰水变浑浊,
(6)为了防止减少酸雨的危害,我们应该对煤和石油进行脱媒处理或清洁能源。

【题目】3.0g某物质完全燃烧后生成4.4gCO2和1.8g水.则对该物质相关判断正确的是( )
| A. | 该物质只含碳、氢元素 |
| B. | 该物质一定含有碳、氢元素,可能含有氧元素 |
| C. | 该物质由碳、氢、氧元素组成 |
| D. | 该物质分子中碳原子和氢原子的个数比为1:1 |
【题目】某化学探究小组的同学准备用碳酸钠溶液与石灰水反应来制取氢氧化钠,并对比NaOH与Ca(OH)2的溶解度。
(1)实验过程:
①把石灰水加入盛有碳酸钠溶液的烧杯中充分搅拌,发生反应的化学方程式:__
②再通过__操作,得到无色滤液.
③将无色滤液通过__操作,得到白色固体.
(2)猜想:得到的白色固体是纯氢氧化钠吗?三位同学分别作出以下猜想:
小玲:是纯净的氢氧化钠!
佳佳:可能还含有碳酸钠!
小强:也可能含有__.
(3)验证:我来验证佳佳的猜想.
实验操作 | 实验现象 | 实验结论 |
取少量白色固体配成溶液,加入足量__ | __ | __ |
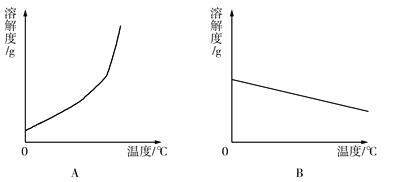
下表是Ca(OH)2和NaOH的溶解度数据。请回答下列问题:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | Ca(OH) | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 |
NaOH | 31 | 91 | 111 | 129 | 313 | 336 | |
(4)依据上表数据,绘制Ca(OH)2和NaOH的溶解度曲线,下图中能表示NaOH溶解度曲线的是_________(填A或B)。
(5)要想把一瓶接近饱和的Ca(OH)2溶液变成饱和溶液,具体措施有:
①加入氢氧化钙,②升高温度,③降低温度,④加入水,⑤蒸发水后再恢复到原温度,⑥加入生石灰。 其中措施正确的是_____。
A.②④⑥ B.③④ C.①③⑤⑥ D.①②⑤⑥
(6)现有20℃时Ca(OH)2的饱和溶液(甲溶液),向其中加入一定量CaO后得到的溶液(乙溶液),此时溶液中溶质的质量分数 乙________甲(填“>”、“<”或“=”)。