题目内容
【题目】某化学兴趣小组在探究稀盐酸的化学性质时,做了如图一所示的三个实验。
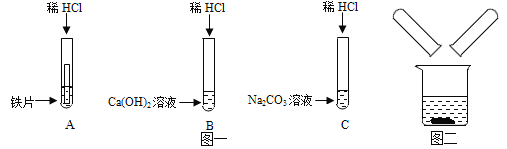
(1)写出实验A中的反应现象_____。
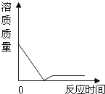
(2)实验结束后,小组同学将B、C两支试管中的废液同时倒入一个清净的烧杯中(如图二所示)观察到先有气泡产生,后有白色沉淀生成。同学们将烧杯内的物质进行过滤,对所得滤液的溶质成分进行探究。
写出上述生成白色沉淀的化学反应方程式_____。
(提出猜想)
甲同学猜想:NaCl;
乙同学猜想:NaCl、CaCl2;
丙同学猜想:NaCl、CaCl2、HCl;
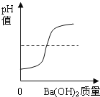
你的猜想:_____。
(交流讨论)你认为_____同学的猜想一定不正确,理由是_____。
(设计实验)请设计实验证明你的猜想正确。
实验步骤 | 实验现象 | 实验结论 |
取少量滤液于试管中,向其中滴加_____ | _____ | 猜想成立 |
【答案】产生气泡、溶液由无色逐渐变为浅绿色 CaCl2+Na2CO3═CaCO3↓+2NaCl NaCl、Na2CO3 丙有白色沉淀产生、滤液中不可能含有HCl CaCl2溶液有白色沉淀产生
【解析】
(1)由于铁与稀盐酸的反应生成了氯化亚铁和氢气,所以A试管中的反应现象铁片表面有气泡产生,溶液由无色逐渐变为浅绿色。发生反应的化学方程式为:Fe+2HCl═FeCl2+H2↑;
(2)在试管中氯化钙与碳酸钠反应生成了碳酸钙和氯化钠,反应的化学方程式是:CaCl2+Na2CO3═CaCO3↓+2NaCl;【提出猜想】由上述分析可知,当碳酸钠与盐酸、氯化钙恰好反应时,滤液中只含有氯化钠;当氯化钙有剩余时,滤液中含有氯化钠和氯化钙,当碳酸钠剩余时,滤液中含有氯化钠和碳酸钠。所以你的猜想是:NaCl、Na2CO3;【交流讨论】由于白色沉淀是CaCO3,能与盐酸反应,二者不能共存,所以丙同学猜想不成立;【设计实验】取少量滤液于试管中,向其中滴加氯化钙,有白色沉淀产生。

 智慧小复习系列答案
智慧小复习系列答案【题目】某课外兴趣小组的同学设计了如下三个实验来验证质量守恒定律:
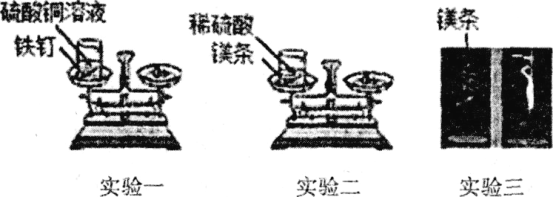
(设计并实验)
(实验一)将盛有硫酸铜溶液的烧杯和铁钉一起放在托盘天平上称量,记录所称的质量。然后将铁钉浸到硫酸铜溶液中,观察现象。待反应一段时间后溶液颜色改变时,将盛有反应后物质的烧杯放在托盘天平上称量,记录所称的质量。
(实验二)将盛有稀硫酸的烧杯和镁条一起放在托盘天平上称量,然后将镁条浸到稀硫酸中,观察现象。待反应一段时间后不再放出气泡时,将盛有反应后物质的烧杯放在托盘天平上称量,记录所称的质量。
(实验三)用天平称量一段砂纸打磨过的镁条的质量并进行记录,然后将该镁条在空气中点燃,待反应结束后,将生成物全部收回,再次进行称量并记录。
上述三个实验所记录的数据见下表。
编号 | 实验一 | 实验二 | 实验三 |
反应前/g | 118.4 | 112.6 | m1 |
反应后/g | 118.4 | 112.4 | m2 |
(分析与讨论)
(1)在这三个实验中,你认为实验________正确反映了反应物与生成物之间的质量关系,由此得出的结论是:在化学反应中生成物的总质量与反应物的总质量相等,请从原子的角度分析结论正确的理由是________。
(2)上述表格中m1和m2的关系是:m1________m2(填>、=或<)
(3)从实验二中得出的结论是:在化学反应中生成物的总质量与反应物的总质量不相等,你认为导致这一结论错误的原因是________.
(实验反思)小组成员从不能正确反映反应物和生成物之间质量关系的实验中,找出了实验设计中的不当之处,并达成了以下共识:设计实验验证质量守恒定律时,对于有空气中的气体(成分)参与或有气体生成的化学反应,一般应使反应在________中进行。
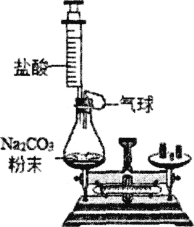
(实验拓展)小明同学从安全的角度考虑,将实验二的装置进行了改进,如图所示.
(1)按如图方式放好仪器,调节天平平衡,记录称量数据.
(2)小明缓慢推动注射器,将稀盐酸加到碳酸钠粉末上,此时察到碳酸钠粉末的表面上有________出现。
(3)此实验中气球的主要作用是________.
(4)当反应结束时,气球已经完全鼓起,小明发现天平的指针已经向右偏了。他感到困惑:其他操作均正常,实验现象与数据为何与预测结果不符?你认为出现该实验现象的合理解释最应该是下列各项中的________(填序号).
A.该反应前后原子的种类、数目变少
B.该反应生成物的总质量小于反应物的总质量
C.空气的浮力作用干扰了实验结果
D.生成气体的反应不遵守质量守恒定律.