题目内容
【题目】为了探究石灰石的纯度(假设样品中的杂质既不溶于水也不与盐酸反应),称取40g石灰石样品等分为4份(分别编号为①②③④),每份样品分别与一定量的稀盐酸反应,所得数据如下表所示:
样品编号 | ① | ② | ③ | ④ |
稀盐酸的质量 | 20g | 40g | m(80<m<130)g | 130g |
剩余固体的质量 | 8g | 6g | 2g | 2g |
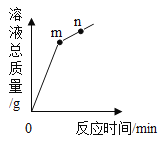
然后,为了探究石灰石与稀盐酸反应后所得废液中的溶质成分,将编号③所得废液过滤,取滤液质量的![]() 于烧杯中,向其中滴加质量分数为10.6%的碳酸钠溶液使其充分反应直至过量,有关的变化如图所示。分析题中有关信息和图象,回答下列问题:
于烧杯中,向其中滴加质量分数为10.6%的碳酸钠溶液使其充分反应直至过量,有关的变化如图所示。分析题中有关信息和图象,回答下列问题:
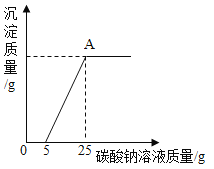
(1)石灰石样品的纯度为_____;
(2)图象中5﹣25阶段发生的反应方程式是_____;
(3)编号③所用稀盐酸的质量m为_____g (要写计算过程)。
【答案】80% CaCl2+Na2CO3═CaCO3↓+2NaCl 100(过程见解析)
【解析】
(1)由最后两次数据知:最后剩余的2g固体为杂质,所以CaCO3的质量为8g,石灰石样品的纯度为:![]() ;
;
(2)由图象可知,图象中5﹣25阶段是碳酸钠能与氯化钙的反应生成了碳酸钙沉淀和氯化钠,反应的化学方程式是:CaCl2+Na2CO3=CaCO3↓+2NaCl;
(3)由表格前两次数据知:每消耗2gCaCO3需要20g稀盐酸,所以8g CaCO3需要消耗盐酸的质量为80g,
设碳酸钙刚好反应完时,消耗HCl的质量为x
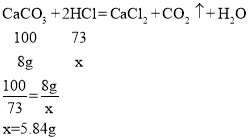
盐酸的质量分数为:![]()
再结合图像可知:当加入5gNa2CO3溶液之前,一直没有沉淀产生,再次说明盐酸过量了
设过量HCl y。
这个时候发生的反应为:
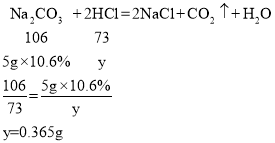
解得:y=0.365g
取滤液质量的![]() 含有氯化氢质量0.365g,故滤液中氯化氢质0.365g×4=1.46g
含有氯化氢质量0.365g,故滤液中氯化氢质0.365g×4=1.46g
所以编号③所用稀盐酸的质量m为:80g+![]() =100g;
=100g;
故答案为:(1)80%;(2)CaCl2+Na2CO3═CaCO3↓+2NaCl;(3)100g。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】同学们在整理实验室时,发现一包白色粉末状药品,老师说该药品由氯化钠、碳酸钙、氢氧化钠中的两种组成,同学们对此很好奇,于是对这包白色粉末的成分进行如下探究。
(作出猜想)猜想一:_______ 猜想二:CaCO3和NaOH 猜想三:NaCl和NaOH
(设计实验)
实验步骤 | 实验现象 | 实验结论 |
(1)取一定量白色粉末于烧杯中,加足量水,搅拌 | ________ | 猜想三不成立 |
(2)取少量(1)中所得溶液于试管中,向其中滴入氯化铜溶液 | ________ | 猜想二不成立 |
(3)另取少量(1)中所得溶液于试管中,向其中滴加过量的____溶液 | 产生白色沉淀 | 猜想一成立 |
写出步骤(3)中发生反应的化学方程式____。
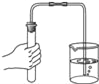
(拓展延伸)如何测定该白色粉末中碳酸钙的质量分数呢?某同学利用碳酸钙能与稀盐酸反应产生二氧化碳来测定该白色粉末中碳酸钙的质量分数,利用下列装置测定二氧化碳的质量。
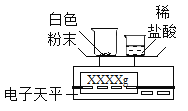
(1)将小烧杯中的所有稀盐酸分几次加入到大烧杯中并不断搅拌,判断白色粉末中碳酸钙完全反应的实验现象是_____。
(2)已知反应前的总质量[m(大烧杯+白色粉末)+m(小烧杯+稀盐酸)],要计算生成CO2的质量,至少还需要的数据是____(填序号)。
A m(小烧杯) B m(大烧杯) C m(大烧杯+反应后剩余物)