题目内容
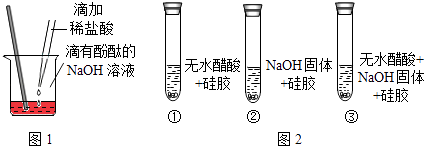
【题目】某化学小组用一定量AgNO3和Al(NO3)3的混合溶液进行了如图实验,已知溶液甲呈蓝色. 
(1)向固体乙上滴加盐酸时(填“有”或“没有”)气泡产生.
(2)溶液甲中一定含有哪些溶质?、、 . (写化学式)
(3)请写出该实验过程中所发生反应的化学方程式 , .
【答案】
(1)没有
(2)Al(NO3)3;Zn(NO3)2;Cu(NO3)2
(3)Zn+2AgNO3=Zn(NO3)2+2Ag;Cu+2AgNO3=Cu(NO3)2+2Ag
【解析】解:在金属活动性顺序中,Al>Zn>H>Cu>Ag,锌与硝酸银反应生成硝酸锌和银,铜与硝酸银反应产生硝酸铜和银,而铝的活动性最强,所以不能发生反应,所以滤液中一定含有反应生成的硝酸锌和没有参加反应的硝酸铝;又因为溶液甲呈蓝色,说明滤液中还一定含有硝酸铜;(1)因为溶液甲呈蓝色,说明滤液中还一定含有硝酸铜,因为有硝酸铜的存在,因此就不会有比铜活动性强的锌剩余,因此过滤、洗涤后往固体乙中加入稀盐酸,无气泡产生;(2)溶液甲中含有没参加反应的硝酸铝,反应产生的硝酸锌,硝酸铜;(3)该实验过程中所发生反应的化学方程式有:锌与硝酸银反应生成硝酸锌和银,铜与硝酸银反应生成硝酸铜和银,反应的化学方程式分别为:Zn+2AgNO3=Zn(NO3)2+2Ag;Cu+2AgNO3=Cu(NO3)2+2Ag. 故答案为:(1)没有;(2)Al(NO3) 3、Zn(NO3)2、Cu(NO3)2;(3)Zn+2AgNO3=Zn(NO3)2+2Ag;Cu+2AgNO3=Cu(NO3)2+2Ag.
根据在金属活动性顺序中,Al>Zn>H>Cu>Ag,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来分析.

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案【题目】请结合下列实验装置图回答有关问题. 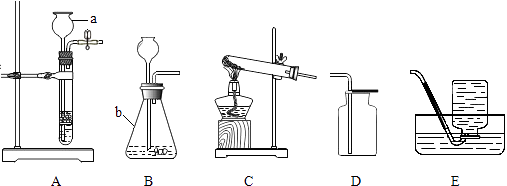
(1)仪器:a用途 , b名称 .
(2)实验室制取二氧化碳气体,装置A、B都可用作发生装置,其中可以控制反应进行的是(填装置序号),反应的化学方程式是 .
(3)同学们分析认为③中剩余溶液中一定有氯化钙,可能有盐酸.为验证是否含有盐酸,他们采用不同方案进行实验,得出相同的结论.
实验操作 | 实验现象 | 结论 | |
方案一 | 取样,加一枚生锈的铁钉 | 有盐酸 | |
方案二 | 取样,滴加AgNO3溶液和稀硝酸 | 产生白色沉淀 |
上述实验方案中,合理的是(选填:“方案一”或“方案二”);另外一个实验方案不合理的原因: . “方案一”中反应的化学方程式为 .
【题目】如表列出了一些常见物质在常温下的 pH 范围,其中呈碱性的是( )
物质名称 | 鸡蛋清 | 牛奶 | 西红柿 | 柠檬汁 |
pH 范围 | 7.6~8.0 | 6.3~6.6 | 4.0~4.4 | 2.0~3.0 |
A.鸡蛋清
B.牛奶
C.西红柿
D.柠檬汁