题目内容
【题目】A、金属钛(Ti)的合金具有耐高温、耐腐蚀、强度高等性能,钛合金广泛用于航空、航天工业及化学工业。工业上以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,同时得到重要的化工原料甲醇(CH3OH)。生产的工艺流程图如图1所示(部分产物略去):
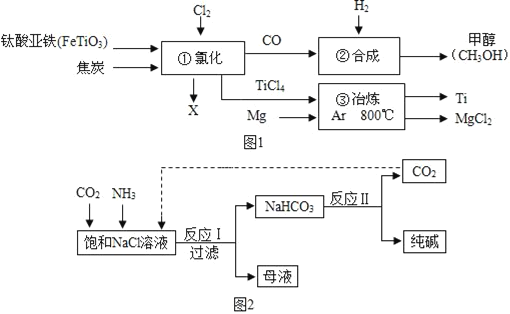
(1)该流程图中涉及到的物质属于有机物的是__。
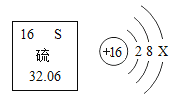
(2)钛酸亚铁(FeTiO3)中钛元素的化合价为__。
(3)①中反应为:2FeTiO3+6C+7Cl2 2X+2TiCl4+6CO,则X的化学式为__。
2X+2TiCl4+6CO,则X的化学式为__。
(4)③所属的基本反应类型为__。
(5)②中为使原料全部转化为甲醇,理论上CO和H2投料的质量比为__。
B、现代工业常以氯化钠为原料制备纯碱,部分工艺流程如图2所示:已知:①NaHCO3在低温下溶解度较小,反应I为:NaCl+CO2+NH3+H2O![]() NaHCO3↓+NH4Cl,
NaHCO3↓+NH4Cl,
②处理母液的方法:向母液中加入石灰乳(熟石灰),其反应为:Ca(OH)2+2NH4Cl═CaCl2+2NH3↑+2H2O
(1)纯碱的化学式为__。
(2)母液中一定含有的溶质是__。
(3)整个流程中可以循环利用的物质是__。
【答案】CH3OH +4 FeCl3 置换反应 7:1 Na2CO3 碳酸氢钠、氯化铵 二氧化碳
【解析】
A、钛酸亚铁、焦炭和氯气反应生成氯化铁、四氯化钛和一氧化碳,一氧化碳和氢气反应生成甲醇,四氯化钛和镁在氩气环境中反应生成钛和氯化镁。
B、二氧化碳、氨气、氯化钠和水反应生成碳酸氢钠和氯化铵,碳酸氢钠分解成碳酸钠、二氧化碳和水。
A、(1)甲醇是含碳化合物,属于有机物。该流程图中涉及到的物质属于有机物的是 CH3OH;
(2)钛酸亚铁(FeTiO3)中由于名称为亚铁,所以铁元素的化合价为+2价,氧元素的化合物为-2价,根据化合物中化合价的代数和为零可得,钛元素的化合价为+4价;
(3)①中反应为:2FeTiO3+6C+7Cl2  2X+2TiCl4+6CO,反应前:铁原子2个,钛原子2个,氧原子6个,碳原子6个,氯原子14个。反应后现有:钛原子2个,氧原子6个,碳原子6个,氯原子8个,则缺铁原子2个,氯原子6个,包含在两个X分子中,所以X的化学式为 FeCl3;
2X+2TiCl4+6CO,反应前:铁原子2个,钛原子2个,氧原子6个,碳原子6个,氯原子14个。反应后现有:钛原子2个,氧原子6个,碳原子6个,氯原子8个,则缺铁原子2个,氯原子6个,包含在两个X分子中,所以X的化学式为 FeCl3;
(4)③是单质镁和和化合物四氯化钛生成单质钛和化合物氯化镁,该反应是由单质与化合物反应生成另一种单质和另一种化合物的反应。属于基本反应类型的置换反应。
(5)②中为使原料全部转化为甲醇,则反应为CO+2H2=CH3OH。
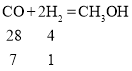
理论上CO和H2投料的质量比为7:1。
B、(1)纯碱的化学式为 Na2CO3;
(2)母液是NaCl+CO2+NH3+H2O ![]() NaHCO3↓+NH4Cl反应得到的,所以含有碳酸氢钠和氯化铵,虽然过滤得到碳酸氢钠,但是剩余液体也是碳酸氢钠的饱和溶液,所以母液中一定含有的溶质是碳酸氢钠、氯化铵;
NaHCO3↓+NH4Cl反应得到的,所以含有碳酸氢钠和氯化铵,虽然过滤得到碳酸氢钠,但是剩余液体也是碳酸氢钠的饱和溶液,所以母液中一定含有的溶质是碳酸氢钠、氯化铵;
(3)开始投入了二氧化碳,结果生成了二氧化碳,所以整个流程中可以循环利用的物质是二氧化碳。