题目内容
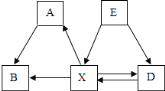
【题目】实验室废液桶中收集了含有硫酸铜、硫酸亚铁和硫酸锌的废水,为减少水污染及节约成本,某班同学准备运用刚学到的“常见金属活动性顺序表”结合其他有关化学知识对废水进行处理,回收重要物质硫酸锌、金属铁和铜,设计如图所示流程:
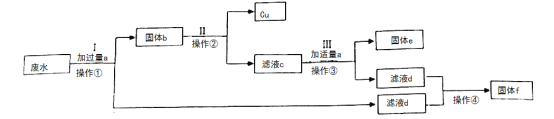
回答下列问题:
(1)固体b的成分是__________;
(2)上述流程的四个操作中,有一个和其它三个不同,它是_______;
(3)过程Ⅱ中可加入的物质是________(填化学式),过程Ⅲ中一定发生的化学反应方程式为___________;
(4)向一定量硝酸银溶液中加入铜和锌的混合粉末,充分反应过滤,得到溶液甲和固体乙。
①若乙中含有锌、铜、银三种固体,则溶液甲中所含的溶质为_________(填化学式);
②若溶液甲显蓝色,则固体乙可能的组成情况有_____________。
【答案】锌、铁、铜(或Zn、Fe、Cu) ④(或操作④或蒸发) H2SO4或CuSO4 Zn+FeSO4=Fe+ZnSO4 Zn(NO3)2 Ag;Ag、Cu
【解析】
由废水中加入过量a物质并进行操作①得到滤液d和固体b可知,操作①是过滤;三种金属中由于锌的活动性最强,故所加过量的a物质为金属锌,锌置换出硫酸亚铁溶液和硫酸铜溶液中的铁和铜,故固体b是锌、铁、铜的混合物,滤液d是硫酸锌溶液。经过程Ⅱ后得到铜和滤液c,则操作②是过滤,过程Ⅱ是从固体b中分离金属铜,得到铜和滤液c,故过程Ⅱ中可加入的物质是硫酸或硫酸铜。滤液c是硫酸亚铁溶液和硫酸锌溶液。过程Ⅲ加适量a(金属锌)后经过滤得到滤液d和金属e,则金属e是铁,滤液d(硫酸锌溶液)经操作④(蒸发)后得到硫酸锌。
(1)由分析知,固体b的成分是锌、铁、铜(或Zn、Fe、Cu);
(2)由分析知,操作①②③都是过滤,操作④是蒸发。故上述流程的四个操作中,有一个和其它三个不同的是④(或操作④或蒸发);
(3) 由分析知,过程Ⅱ中可加入的物质是硫酸或硫酸铜,化学式为H2SO4或CuSO4,过程Ⅲ中锌置换出硫酸亚铁溶液中的铁,反应的化学方程式为:Zn+FeSO4=Fe+ZnSO4;
(4) ①若乙中含有锌、铜、银三种固体,说明混合粉末中锌的含量较多,将硝酸银溶液中的银完全置换出来。故溶液甲中所含的溶质为硝酸锌,化学式为Zn(NO3)2;
②若溶液甲显蓝色,说明金属锌反应完,金属铜参与反应(金属铜可能是部分参加反应也可能是全部参加反应),置换出硝酸银溶液中的银。若铜部分参加反应,则固体乙是铜、银;若铜全部参加反应,则固体乙是银。故固体乙可能的组成情况有Ag;Ag、Cu。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案【题目】“配制一定溶质质量分数的氯化钠溶液”是初中化学的基础实验之一。请回答下列问题:
(1)现欲配制一瓶500g溶质质量分数为0.9%的氯化钠溶液,需氯化钠固体______g.
(2)下列实验操作与分析均正确的一组是__________(填序号)。
项目 | 实验操作 | 分析 |
A | 称量时,将取出的过量氯化钠放回原瓶 | 节约药品 |
B | 溶解氯化钠时用玻璃棒搅拌 | 增大氯化钠的溶解度 |
C | 称取氯化钠时,在天平两边托盘上各放一张质量相等的纸 | 整洁美观 |
D | 量取所需水时,视线与量筒内液体凹液面的最低处保持水 | 准确读数 |
(3)实验室若用溶质质量分数为15%的氯化钠溶液配制成溶质质量分数为5%的氯化钠溶液60g,此时需要用到的玻璃仪器有烧杯、玻璃棒、量筒和________,需要加水的质量为____g.
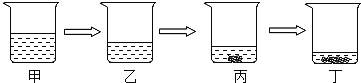
(4)实验室若用恒温蒸发的方法将15%的氯化钠溶液变成饱和溶液,其过程如下图所示,与丙烧杯中溶液溶质质量分数一定相同的是_________(填序号)烧杯中的溶液。
【题目】(1)四种铁矿石的主要成分是:①Fe2O3 ②Fe3O4 ③FeCO3 ④FeS2,这四种化合物含铁的质量分数由高到低的顺序是_____________(填序号)。
(2)近年来,有不法分子利用假金欺骗群众,假金外观像黄金,但它是一种铜与金属M的合金。某同学想确定金属M,已知金属M为+2价,他取用3.5 g这种假金样品,把15.0g含HCl14.6%的稀盐酸分3次加入,充分反应后剩余固体质量见表:
第1次 | 第2次 | 第3次 | |
稀盐酸的用量/g | 5.0 | 5.0 | 5.0 |
剩余固体质量/g | 2.85 | 2.2 | 2.0 |
①计算该假金样品中铜的质量分数______;
②通过计算确定M是何种金属__________。