题目内容
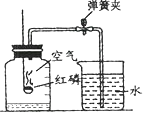
【题目】某同学用下图所示装置研究质量守恒定律的相关问题。

反应前称得总质量为m1,将足量稀硫酸全部倒入烧杯,充分反应后,称得总质量为m2。
(1)m1≠m2的原因是______(用化学方程式表示)。该反应是否遵守质量守恒定律______(填“是”或“否”)。
(2)理论上m1和m2的差值是______ g。
【答案】 Zn + H2SO4 === ZnSO4 + H2↑ 是 0.2
【解析】(1)根据锌与稀硫酸反应生成硫酸锌和氢气解答;凡是化学反应都遵守质量守恒定律;(2)根据锌的质量结合反应的化学方程式求生成氢气的质量。(1)锌与稀硫酸反应生成硫酸锌和氢气,该反应的化学方程式是Zn+H2SO4=ZnSO4+H2↑;该反应遵守质量守恒定律;
(2)设生成氢气的质量为x。
Zn+H2SO4=ZnSO4+H2↑
65 2
6.5g x
![]()
x=0.2g

练习册系列答案
相关题目