题目内容
【题目】A—G是初中化学常见的物质,暗紫色固体A加热可分解成无色气体B、黑色固体C以及另一固体物质;黑色物质C放入某无色溶液D中迅速产生大量气体B;金属E能在B中剧烈燃烧,生成黑色固体F;另一黑色固体G在B中燃烧产生能使石灰水变浑浊的气体。
(1)B的化学式__________,F化学式__________,溶液D的俗称__________;
(2)写出E在B中燃烧的反应的文字表达式:__________________;
(3) G在B中燃烧的现象________________。
【答案】O2 Fe3O4 双氧水 铁+氧气![]() 四氧化三铁 剧烈燃烧,发白光,放热
四氧化三铁 剧烈燃烧,发白光,放热
【解析】
将某暗紫色固体粉末A加热,可产生无色气体B,同时生成一种黑色固体C和另一种固体物质,初中化学中接触的到的紫黑色固体受热能分解的只有高锰酸钾,高锰酸钾加加热分解生成锰酸钾、二氧化锰和氧气,因此A是高锰酸钾,B是氧气,C是二氧化锰,另一种固体物质是锰酸钾;黑色物质C(二氧化锰)放入某无色溶液D中迅速产生大量气体B(氧气),过氧化氢在二氧化锰催化作用下分解生成水和氧气,D是过氧化氢溶液;金属E能在B(氧气)中剧烈燃烧,生成黑色固体F,铁能在氧气中剧烈燃烧,生成黑色固体四氧化三铁,故E是铁,F是四氧化三铁;另一黑色固体G在B(氧气)中燃烧产生能使石灰水变浑浊的气体,能使石灰水变浑浊的气体是二氧化碳,碳在氧气中燃烧生成二氧化碳,G是碳。经过验证,推导正确。
根据以上分析可知:
(1)B是氧气,化学式为O2,F是四氧化三铁,化学式为Fe3O4,溶液D是过氧化氢溶液俗称双氧水;
(2)E在B中燃烧的反应是铁能在氧气中燃烧,生成体四氧化三铁,反应的文字表达式为:铁+氧气![]() 四氧化三铁;
四氧化三铁;
(3) 碳在氧气中燃烧的现象是剧烈燃烧,发白光,放热。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某课外小组研究“影响H2O2 生成O2快慢的因素”的课题。通过查阅资料,他们提出如下猜想。
(提出猜想)催化剂和反应物浓度都会影响H2O2 生成O2 的快慢
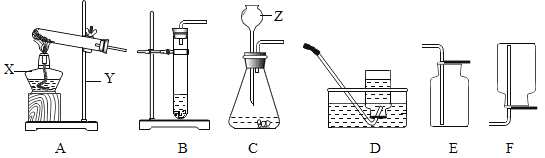
(实验过程)实验装置图如下:
实验操作:检查装置气密性良好。将分液漏斗中的液体加入锥形瓶中,立即收集一瓶放出的气体。实验记录
实验编号 | ① | ② | ③ |
反应物 | 5%H2O2 100 mL | 5%H2O2 | 3%H2O2 100 mL |
加入固体 | 0.5 g氯化钠固体 | 0.5 g二氧化锰 | |
收集气体的时间 | 165 s | 46 s | 80 s |
(1)实验②中加入H2O2的体积为_________mL。
(2)实验③中加入的固体和用量为___________。
(结论)该探究过程得出的结论是 ___________。
(反思)H2O2在常温下分解缓慢,加入MnO2 后反应明显加快。小红提出,为了更好的证明二氧化锰和氯化钠是否对H2O2 生成O2快慢有影响,还应该增加一组对比实验。该实验选用的药品和用量为______。
(实验拓展)小红用排水法收集的气体进行氧气的性质实验。
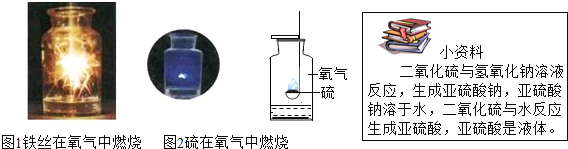
(1)小红进行硫磺和氧气的反应的性质实验时,在空气中与在氧气中对比燃烧,现象差别不明显。造成这种结果的原因是_________________。
(2)为探究影响过氧化氢分解速度的因素,小雨阅读课外资料得知:过氧化氢分解除了用二氧化锰,还可用氧化铜等物质作催化剂。于是在室温下做了如下实验,实验数据记录如下:
过氧化氢的质量 | 过氧化氢的浓度 | CuO的质量 | 相同时间内产生O2体积 | |
Ⅰ | 100.0g | 1% | 0.0g | 5 mL |
Ⅱ | 100.0g | 1% | 2g | 32 mL |
Ⅲ | 100.0g | 4% | 2g | 64 mL |
①本实验中,测量O2体积的装置是________(填编号)。
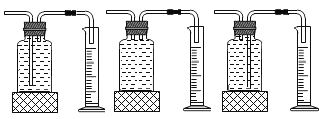
②通过对上表数据分析,I和II对比影响过氧化氢分解速率的因素是__________;III和II对比影响过氧化氢分解速率的因素是______
③写出该反应的文字表达式__________
④小雨进认为只根据加入CuO在反应中的现象还不能确定其为催化剂,还需验证__
⑤小雨利用上述原理制氧气,若达到可随时控制生成气体的速度的目的,应选择的发生装置________填序号)。