题目内容
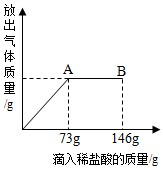
 在一烧杯中盛有22.3g Na2CO3和NaCl组成的固体混合物,加143.1g水溶解,制成溶液.向其中逐渐滴加溶质质量分数为10%的稀盐酸,放出气体总质量与所滴入稀盐酸的质量关系曲线如图所示:
在一烧杯中盛有22.3g Na2CO3和NaCl组成的固体混合物,加143.1g水溶解,制成溶液.向其中逐渐滴加溶质质量分数为10%的稀盐酸,放出气体总质量与所滴入稀盐酸的质量关系曲线如图所示:请根据题意回答问题
(1)当滴加了73g稀盐酸时,放出气体的总质量为
(2)当滴加稀盐酸至图中A点时,烧杯中所得的溶液溶质的质量分数是
(3)当滴加稀盐酸至图中B点时,烧杯中溶液里的溶质是(写化学式)
分析:(1)因为NaCl与盐酸不能互相交换成分,所以不反应.因此只要计算出碳酸钠与73g稀盐酸反应生成的气体质量即可.根据反应的化学方程式,得出各物质之间的质量比,列出比例式,就可计算出放出气体的质量.
(2)根据题意分析,A点时已是完全反应,溶液里的溶质有混合物中原有的氯化钠和生成物中的氯化钠.根据反应的化学方程式,得出各物质之间的质量比,列出比例式,就可计算出混合物中Na2CO3的质量和反应生成的NaCl的质量.混合物的总质量减去Na2CO3的质量就是混合物中原有的氯化钠的质量,再加上反应生成的NaCl的质量就是所含溶质的质量;根据质量守恒定律可以求得反应后溶液的总质量;最后根据溶质质量分数=
×100%即可求得在A点时烧杯中所得的溶液溶质的质量分数.
(3)由图示可知,当滴加稀盐酸至图中A点时,已是完全反应,再滴加稀盐酸至图中B点时,盐酸就有剩余,这时溶液中的溶质就有氯化钠和氯化氢.
(2)根据题意分析,A点时已是完全反应,溶液里的溶质有混合物中原有的氯化钠和生成物中的氯化钠.根据反应的化学方程式,得出各物质之间的质量比,列出比例式,就可计算出混合物中Na2CO3的质量和反应生成的NaCl的质量.混合物的总质量减去Na2CO3的质量就是混合物中原有的氯化钠的质量,再加上反应生成的NaCl的质量就是所含溶质的质量;根据质量守恒定律可以求得反应后溶液的总质量;最后根据溶质质量分数=
| 溶质质量 |
| 溶液质量 |
(3)由图示可知,当滴加稀盐酸至图中A点时,已是完全反应,再滴加稀盐酸至图中B点时,盐酸就有剩余,这时溶液中的溶质就有氯化钠和氯化氢.
解答:解;(1)设放出气体的总质量为x,
Na2CO3+2HCl═2NaCl+H2O+CO2↑
73 44
73g×10% x
=
解得:x=4.4g
故答案为:4.4.
(2)设反应后生成NaCl的质量为z,混合物中Na2CO3的质量为y.
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73 117
y 73g×10% z
=
,
=
;
解得:y=10.6g,z=11.7g;
反应后溶质NaCl的质量=11.7g+22.3g-10.6g=23.4g.
此时溶液的质量为:22.3g+143.1g+73g-4.4g=234g;
则该溶液的溶质质量分数为:
×100%=10%.
(3)由图示可知,当滴加稀盐酸至图中A点时,已是完全反应,再滴加稀盐酸至图中B点时,盐酸就有剩余.
故烧杯中溶液里的溶质是NaCl和HCl.
故答案为:
(1)4.4;
(2)10%;
(3)NaCl和HCl.
Na2CO3+2HCl═2NaCl+H2O+CO2↑
73 44
73g×10% x
| 73 |
| 73g×10% |
| 44 |
| x |
解得:x=4.4g
故答案为:4.4.
(2)设反应后生成NaCl的质量为z,混合物中Na2CO3的质量为y.
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73 117
y 73g×10% z
| 106 |
| y |
| 73 |
| 73g×10% |
| 117 |
| z |
| 73 |
| 73g×10% |
解得:y=10.6g,z=11.7g;
反应后溶质NaCl的质量=11.7g+22.3g-10.6g=23.4g.
此时溶液的质量为:22.3g+143.1g+73g-4.4g=234g;
则该溶液的溶质质量分数为:
| 23.4g |
| 234g |
(3)由图示可知,当滴加稀盐酸至图中A点时,已是完全反应,再滴加稀盐酸至图中B点时,盐酸就有剩余.
故烧杯中溶液里的溶质是NaCl和HCl.
故答案为:
(1)4.4;
(2)10%;
(3)NaCl和HCl.
点评:本题主要考查学生对完全反应的认识和运用化学方程式进行计算的能力;根据质量守恒,反应后溶液的质量=固体混合质量+加入稀盐酸质量-放出气体质量.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 在一烧杯中盛有22.3gNa2CO3和NaCl组成的固体混合物,向其中逐渐滴加溶质质量分数为10%的稀盐酸,放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示:请根据题意回答问题:
在一烧杯中盛有22.3gNa2CO3和NaCl组成的固体混合物,向其中逐渐滴加溶质质量分数为10%的稀盐酸,放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示:请根据题意回答问题: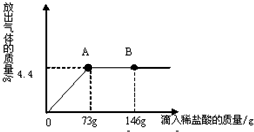
 在一烧杯中盛有22.3g Na2CO3和NaCl组成的固体混合物,加143.1g水溶解,制成溶液.
在一烧杯中盛有22.3g Na2CO3和NaCl组成的固体混合物,加143.1g水溶解,制成溶液. (2013?昆都仑区一模)在一烧杯中盛有22.3Na2CO3和NaCl组成的固体混合物,加入109.1g 水使其完全溶解,配成溶液.向其中逐渐滴加溶质质量分数为10%的稀盐酸,放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示.请根据题意回答问题:
(2013?昆都仑区一模)在一烧杯中盛有22.3Na2CO3和NaCl组成的固体混合物,加入109.1g 水使其完全溶解,配成溶液.向其中逐渐滴加溶质质量分数为10%的稀盐酸,放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示.请根据题意回答问题: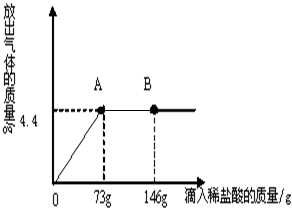 小刚在化学实验室发现,盛放NaOH溶液的试剂瓶瓶口和橡皮塞上出现了白色粉末.小刚叫来小军和小红,共同探究这种白色粉末的成分.
小刚在化学实验室发现,盛放NaOH溶液的试剂瓶瓶口和橡皮塞上出现了白色粉末.小刚叫来小军和小红,共同探究这种白色粉末的成分.