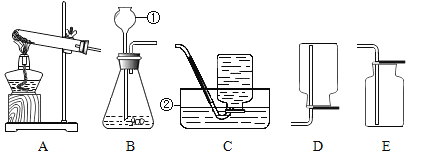
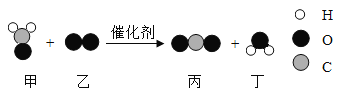
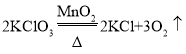题目内容
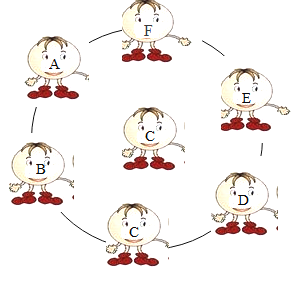
【题目】A~H 和 X 都是初中化学中常见的物质,其中 A、D 是无色气体,B、E 是红色固体,B是工业生产常见的铁矿石,F 为白色沉淀,H 为红褐色沉淀,它们的转化关系如图所示(部分生成物已省略):

(1)写出下列字母所代表物质的化学式:A:_____H: _____X:_____;
(2)写出 E 在生活中常见用途_____,C 的常见合金名称:_____,它的合金属于_____材料(填“合成”或“金属”)
(3)写出过程③的化学方程式_____;
(4)写出④的化学方程式_____;该反应属于_____反应(填基本反应类型)。
【答案】CO Fe(OH)3 CuSO4 用作导线 生铁和钢 金属 CO2+Ca(OH)2═CaCO3↓+H2O Fe2O3+3H2SO4═Fe2(SO4)3+3H2O 复分解
【解析】
据A~H和X都是初中化学中常见物质,其中A、D是无色气体,F为白色沉淀;由D是气体能与石灰水反应生成F为白色沉淀,所以D是二氧化碳;B、E是红色固体,B是工业生产常见的铁矿石,气体A能与红色固体B反应生成C和气体D-二氧化碳,C能够和X溶液反应产生红色固体E,红色固体有铜和氧化铁,因此A可以是一氧化碳,B是氧化铁,生成的D是二氧化碳,则F是碳酸钙;而铁和铜盐,如硫酸铜可以反应产生红色的铜,所以C是铁,X是硫酸铜;根据“H为红褐色”,则推测H为氢氧化铁,带入验证符合题意。
(1)A是一氧化碳,H是氢氧化铁,X是硫酸铜;故填:CO;Fe(OH)3;CuSO4;
(2)E是铜,铜可以用作导线;铁的合金有生铁和钢,合金属于金属材料;故填:用作导线;生铁和钢;金属;
(3)反应③二氧化碳与氢氧化钙反应生成碳酸钙和水,反应的化学方程式为:CO2+Ca(OH)2═CaCO3↓+H2O;故填:CO2+Ca(OH)2═CaCO3↓+H2O;
(4)反应④是氧化铁能与稀硫酸反应生成硫酸铁和水,故反应的化学方程式为:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;该反应是两种化合物交换成分生成另外两种化合物,属于复分解反应。故填:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;复分解。

 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案【题目】在学习实验室制取二氧化碳选用试剂研究中,一般都会以块状大理石和稀盐酸、粉末状大理石与稀盐酸、碳酸钠与稀盐酸、块状大理石与稀硫酸进行对比实验探究。化 学兴趣小组就除反应物状态以外影响大理石与稀盐酸反应快慢因素进行了如下探究。
(提出问题)大理石与稀盐酸反应的快慢还会受哪些因素的影响?
(猜想假设)
假设一:可能与温度的高低有关。 假设二:可能与稀盐酸的浓度有关。
(设计并实验)小组成员用不同质量分数的稀盐酸和不同环境温度下进行如下实验:
实验 序号 | 盐酸的质量分数 (均取 20mL) | 大理石 的质量 | 实验环 境温度 | 收集相同体积的二氧 化碳所用时间(秒) |
1 | 10% | 2g | 20℃ | 59.8 |
2 | 10% | 2g | 35℃ | 41.7 |
3 | 20% | 2g | 20℃ | 35.5 |
4 | 20% | 2g | 35℃ | 27.2 |
(1) 写出实验室制取二氧化碳的反应化学方程式_____。
(收集证据)
(2) 要比较不同温度对反应快慢的影响应选择实验编号是_____;要比较不同质量分 数的稀盐酸对反应快慢的影响应选择实验编号是_____。
(总结反思)
(3)小组经过讨论分析得出如下结论:
a、温度与大理石与稀盐酸反应快慢的关系:_____;
b、稀盐酸浓度与大理石与稀盐酸反应快慢的关系:___________________。
(4)本实验除用收集相同体积气体所需要的时间这一产生产物的快慢来定量比较反应速率快慢外,还可以采用其他什么方法来比较反应速率的快慢(除观察产生气泡的快慢)? 答:_____。