题目内容
【题目】将一定质量的NaCl和Na2SO4固体混合物放入烧杯后,加入一定质量分数的BaCl2溶液208g,恰好完全反应,过滤,得到23.3g沉淀。经测定滤液中含氯元素的质量为21.3g(不考虑过滤过程中物质质量的损失)。计算:
(1)所加BaCl2溶液的溶质质量分数。
(2)原固体混合物中Na2SO4的质量。
(3)求反应后所得溶液的溶质的质量分数(计算结果保留一位小数)
【答案】(1)10% (2)14.2 (3)15.8%
【解析】
氯化钠不能和氯化钡反应,硫酸钠和氯化钡反应生成白色沉淀硫酸钡和氯化钠,根据反应的化学方程式及其提供的数据可以进行相关方面的计算和判断.
(1)设氯化钡质量为x,硫酸钠质量为y,生成氯化钠的质量为z,
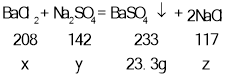
![]()
x=20.8g,y=14.2g,z=11.7g,
所加BaCl2溶液的溶质质量分数为:![]() ×100%=10%,
×100%=10%,
答:所加BaCl2溶液的溶质质量分数为10%.
(2)答:原固体混合物中Na2SO4的质量是14.2g.
(3)滤液中含氯元素的质量为21.3g,则滤液中氯化钠质量为:
21.3g÷(![]() ×100%)=35.1g,
×100%)=35.1g,
NaCl和Na2SO4固体混合物中氯化钠质量为:35.1g﹣11.7g=23.4g,
所得溶液的质量为:23.4g+14.2g+208g﹣23.3g=222.3g,
所得溶液的溶质质量分数为:![]() ×100%=15.8%,
×100%=15.8%,
答:所得溶液的溶质质量分数为15.8%.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目