题目内容
【题目】某小组在探究铜、铁、银三种金属活动性顺序时,从下列药品中选择三种药品进行探究:铜丝、铁丝、银丝、硫酸亚铁溶液、硫酸铜溶液、硝酸银溶液。
请你帮助他们设计并完成两种实验方案:
方案 | 实验药品 | 实验操作 | 实验现象 | 反应方程 | 实验结论 |
方案一 | 铁丝、银丝、硫酸铜溶液 | 把铁丝银丝分别插入到硫酸铜溶液中 | (3)_____ 银丝表面无现象 | 方程式略 | 铁>铜>银 |
方案二 | (1)_____ | (2)_____ | 现象略去 | (4)____ |
【答案】铁丝表面覆盖一层红色物质,溶液由蓝色变成浅绿色 铜丝、硫酸亚铁溶液、硝酸银溶液 将铜丝分别插入到硫酸亚铁溶液、硝酸银溶液 ![]()
【解析】
在金属活动性顺序中,设计实验证明金属的活动性顺序,可以使用活动性居中的金属为单质、强和弱的金属为盐溶液的方法,或是活动性居中的金属为盐溶液,强和弱的金属为单质的方法,也可以使用加酸观察是否产生气体的方法。
方案一:由于铁的活泼性大于铜,铁与硫酸铜反应生成铜和硫酸亚铁,所以将铁丝放入硫酸铜溶液中发生反应的现象是铁丝表面有一层红色固体生成,溶液由蓝色变为浅绿色。故答案为:铁丝表面有一层红色固体生成,溶液由蓝色变为浅绿色;
方案二:在金属活动性顺序中,Fe>Cu>Ag,使用活动性居中的金属铜单质,则需使用铁的盐溶液和银盐溶液,所以实验方案是:将铜分别放入硫酸亚铁溶液和硝酸银溶液中。前者铜不能与硫酸亚铁反应,证明铁的活动性比铜强,后者铜的表面有银白色固体析出,证明铜的活动性比银强;铜和硝酸银反应生成银和硝酸铜,反应的化学方程式为Cu+2AgNO3=2Ag+Cu(NO3)2.故答案为:硫酸亚铁溶液、铜丝、硝酸银溶液;将铜丝分别插入到硫酸亚铁溶液、硝酸银溶液;Cu+2AgNO3=2Ag+Cu(NO3)2。

【题目】硫酸铜晶体常用于杀虫、杀菌,用废铜料(含少量铁)生产硫酸铜晶体的流程如图所示,请回答下列问题.
![]()
(1)操作 a 的名称是_____;
(2)废铜料中加入足量试剂 X 的目的是_____;
(3)黑色固体 B 与试剂 X 的反应化学方程式是______;
(4)盛放硫酸铜溶液不宜用铁制容器的原因是(用化学方程式解释)______;
(5)根据硫酸铜的溶解度表格所示,最后硫酸铜溶液可以通过蒸发浓缩、_____,过滤、洗涤、干燥的方法得到硫酸铜晶体。
0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 60℃ | 80℃ | 100℃ | |
硫酸铜/g | 23.1 | 27.5 | 32 | 37.8 | 44.6 | 61.8 | 83.8 | 114 |
【题目】为探究盐酸的化学性质,某化学小组做了如下实验:
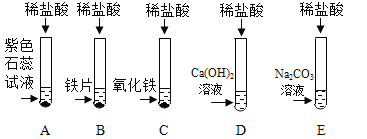
(1)C 试管中所发生反应的化学方程式为 ____________ 。
(2)将反应后 D、E 试管中的废液倒入一个洁净的烧杯中,观察到烧杯中先有气泡产生,后有白色沉淀出现。将烧杯 中的混合物过滤,得到白色沉淀和无色滤液。同学们对滤液中溶质的成分进行探究。 (提出问题)滤液中溶质的成分是什么?
(作出猜想)猜想一:NaCl。
猜想二:NaCl 和 CaCl2。
猜想三:__________________。
猜想四:NaCl、Ca(OH)2和 HCl 。
老师指出猜想四是错误的,原因是_______________。 (设计实验)请完成实验报告。
实验步骤 | 实验现象 | 实验结论 |
甲取少量滤液于试管中,滴加适量的碳酸钠溶液 | _____________ | 猜想二不成立 |
乙取少量滤液于试管中,滴加__________(填名称) | 出现气泡 | 猜想三成立 |