题目内容
【题目】通过下列在溶液中进行的实验,探究复分解反应条件,回答:
①![]() ②
②![]() ③
③![]()
④![]() ⑤
⑤![]() ⑥
⑥![]()
(1)请写出实验③涉及的化学反应方程式_____;
(2)同学们将实验后的所有物质倒入同一烧杯中,后续实验及现象如下:
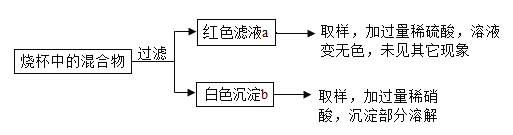
①白色沉淀b的成分是_____;
②下列有关红色滤液a和白色沉淀b的设想中,合理的是_____。
A 鉴别![]() 溶液和
溶液和![]() 溶液:取样,分别滴加所得红色滤液a
溶液:取样,分别滴加所得红色滤液a
B 检验![]() 溶液中是否含有
溶液中是否含有![]() :取样,滴加红色滤液a
:取样,滴加红色滤液a
C 除去![]() 溶液中的
溶液中的![]() :加入适量的溶液a
:加入适量的溶液a
D 获得![]() 固体:将白色沉淀b放入过量的稀盐酸中,充分反应后过滤,洗涤,干燥
固体:将白色沉淀b放入过量的稀盐酸中,充分反应后过滤,洗涤,干燥
【答案】H2SO4+Na2CO3=Na2SO4+H2O+CO2↑ BaSO4、BaCO3 BD
【解析】
(1)实验③为H2SO4+Na2CO3反应,反应的化学反应方程式为H2SO4+Na2CO3=Na2SO4+H2O+CO2↑;
(2)①白色沉淀b加入稀硝酸,沉淀部分溶解,故含有不溶于硝酸的硫酸钡和能与盐酸反应的碳酸钡;
②红色滤液a呈碱性,加入过量稀硫酸,溶液变为无色,没有其他现象,说明其中含有氢氧化钠,但是不能确定硫酸钠的存在,肯定不含氯化钡;白色沉淀b中含有硫酸钡和碳酸钡;
A.鉴别MgCl2溶液和BaCl2溶液:取样,分别滴加所得红色滤液a,则a中含有的氢氧化钠能与氯化镁反应生成氢氧化镁沉淀,若是含有硫酸钠,则氯化钡与硫酸钠反应生成硫酸钡白色沉淀,不能鉴别,错误;
B.检验CaCl2溶液中是否含有HCl:取样,滴加红色滤液a,则其中的氢氧化钠和盐酸反应生成氯化钠和水,溶液的碱性消失,红色褪去,正确;
C.除去NaNO3溶液中的HNO3:加入适量的溶液a,则氢氧化钠和硝酸反应生成硝酸钠和水,a中可能含有硫酸钠,错误;
D.获得BaSO4固体:将白色沉淀b放入过量的稀盐酸中,碳酸钡反应,而硫酸钡不反应,充分反应后过滤,洗涤,干燥,正确;故选BD。

【题目】某兴趣小组在学习氧气的化学性质时,发现不同物质在氧气中燃烧现象不同。

(1)下列物质在氧气中燃烧产物为气体的是_____(填序号)。
A.红磷 B.铁丝 C.木炭 D.硫粉
(2)铁丝在氧气中燃烧的化学方程式:_____。
(3)铁丝在氧气中燃烧没有火焰,而蜡烛在氧气中燃烧却有明亮的火焰。该小组同学进行了如下探究。
探究一:蜡烛燃烧产生火焰的原因是什么?
点燃蜡烛,将金属导管一端伸入内焰,导出其中物质,在另一端管口点燃,也有火焰产生(如图所示)。由此可知:蜡烛燃烧产生的火焰是由_____(填“固态”或“气态”)物质燃烧形成的。
探究二:物质燃烧产生火焰的根本原因是什么?
(查阅资料)
物质 | 熔点/℃ | 沸点/℃ | 燃烧时温度/℃ |
石蜡 | 50∽70 | 300∽550 | 约600 |
铁 | 1535 | 2750 | 约1800 |
钠 | 97.8 | 883 | 约1400 |
由上表可知:物质燃烧能否产生火焰与其_____(填“熔点”或“沸点”)和燃烧时温度有关。通过上表中石蜡、铁的数据对比,你认为物质燃烧时,什么情况下能产生火焰_____。
由此推测:钠在燃烧时,_____(填“有”或“没有”)火焰产生。
(拓展应用)根据硫在空气或氧气中燃烧的实验事实,请你推测硫的沸点_____硫燃烧时的温度(填“>”或“<”或“=”)。
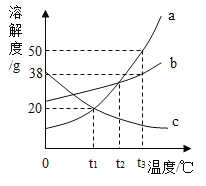
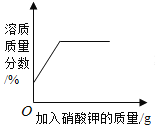
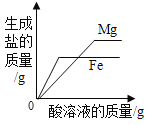
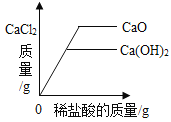
【题目】下列4个图像不能正确反映对应变化关系的是
|
|
|
|
A20°C时,向一定量的硝酸钾不饱和溶液中加人硝酸钾固体 | B向等质量的镁粉和铁粉中分别逐滴加入同浓度的稀盐酸至过量 | C等质量CaO和Ca(OH)2中分别加入等浓度 的稀盐酸至过量 | D向 盛有少量二氧化锰的烧杯中不断地加入 过氧化氢溶液 |
A.AB.BC.CD.D
【题目】某课外兴趣小组为探究一久置的铝片中铝元素的质量分数,他们取8g该铝片样品放入烧杯中,并依次加入一定质量的相同浓度的稀盐酸,测得相关数据如下,请回答问题。
实验次数 | 1 | 2 | 3 | 4 | 5 |
每次加入稀盐酸的质量/g | 50.0 | 100.0 | 100.0 | 100.0 | 100.0 |
产生气体的总质量/g | 0 | 0.2 | a | 0.6 | 0.7 |
(1)a的数值为_______。
(2)计算所用稀盐酸的溶质质量分数______ (结果保留至0.1%,下同) 。
(3)求该铝片中铝元素的质量分数______。