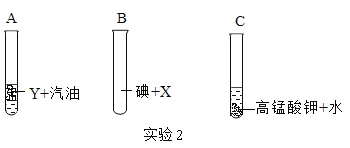
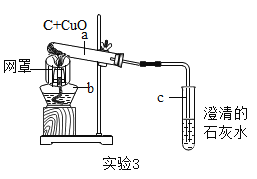
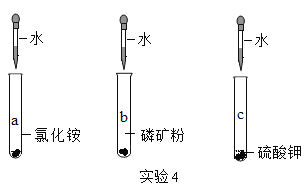
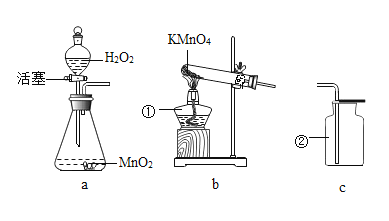
题目内容
【题目】下列图像能正确反映其对应关系的是
A.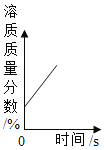 将浓硫酸敝口放置在空气中
将浓硫酸敝口放置在空气中
B.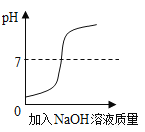 向稀盐酸中滴加过量的氢氧化钠溶液
向稀盐酸中滴加过量的氢氧化钠溶液
C.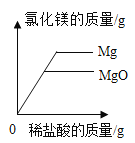 向等质量的氧化镁和镁中分别加入溶质质量分数相同的稀盐酸至过量
向等质量的氧化镁和镁中分别加入溶质质量分数相同的稀盐酸至过量
D.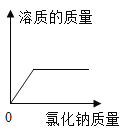 向接近饱和的氯化钠溶液中不断加入氯化钠固体
向接近饱和的氯化钠溶液中不断加入氯化钠固体
【答案】BC
【解析】
A、浓硫酸能够吸收空气中的水蒸气,将浓硫酸露置在空气中时,硫酸质量分数会降低,故选项错误;
B、刚开始稀盐酸PH小于7,当加入氢氧化钠与其反应,PH逐渐增大到等于7;当稀盐酸全部反应后,随着氢氧化钠增多,PH又逐渐增大,并最终大于7,故选项正确;
C、等质量的氧化镁、镁中,镁中含有的镁元素的质量多,分别加入质量分数相同的稀盐酸至过量,镁生成氯化镁的质量多,故选项正确;
D、在一定温度下,向接近饱和的氯化钠溶液中不断加入氯化钠,氯化钠会不断的溶解,当达到饱和后,氯化钠不再继续溶解,溶质的质量当达到饱和后质量不再改变,但不是从0开始,故选项错误。
故选BC。

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案【题目】据统计,我国每年报废的手机超过1亿部,若不进行有效回收利用,会造成巨大的浪费和污染。同学们对废旧手机中的金属回收产生兴趣。

[提出问题]从废旧手机中可以回收到哪些有价值的金属?如何回收?
[查阅资料] I,手机电路板中的金属及其价格如下表所示:
种类 | Fe | Cu | Al | Ni (镍) | Au | Ag | Pd (钯) |
市场价格/ ( $/t) | 365 | 7175.5 | 1710.5 | 14235 | 4.7*107 | 7.6*105 | 2.7*107 |
矿石中含量 | 72.4 | 0.87 | 29.1 | 1.02 | 4 | 120 | 0.4 |
手机电路板中含量 | 5 | 13 | 1 | 0.1 | 350 | 1380 | 210 |
说明: Fe、Cu、 A1、 Ni的含量用质量分数(%)表示,Au、 Ag、 Pd的含量的单位为“g/t”。
II. Ni的金属活动性位于氢前;Pd 的金属活动性位于氢后;NiCl2 溶液为绿色。
Ⅲ.![]()
[实验方案]第一步:选择值得回收的金属。
依据资料I中的数据,废旧手机中有回收价值的金属有Au、Ag、Cu、Pd, 原因是:①它们的市场价格较高;②__________________。
第二步:设计实验分离、回收部分金属。
序号 | 实验步骤 | 实验现象 |
Ⅰ | 取一废旧手机电路板,用电吹风机靠近电路焊接点的焊锡吹热风,一段时间后,用镊子将金属电路从塑料板中拽出 | 焊锡熔化 |
Ⅱ | 将金属电路放入烧杯中,加入过量稀盐酸浸泡 | _______________ |
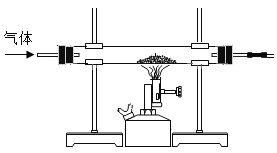
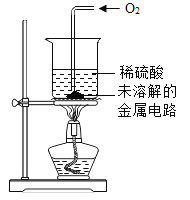
Ⅲ | 取II中未溶解的金属电路,用蒸馏水洗净后,放入如图所示装置中,进行实验。 | 溶液逐渐变成蓝色,仍有微量金属固体未溶解 |
Ⅳ | 过滤Ⅲ中烧杯中的物质,洗涤滤纸上的物质 | 滤纸上仍有微量金属固体 |
Ⅴ | _______________ | _______________ |
[问题讨论]
(1)由步骤I中的现象,可推知的焊锡的物理性质是______________。
(2)步骤II对应的实验现象是______________。
(3)步骤II所得溶液中,一定含有的金属元素是____________。
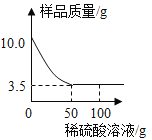
(4)步骤V的操作是:“向步骤IV获得滤液中加入一定量铁粉”。若该实验过程加入铁粉前后溶液中主要离子变化示意图如图所示。
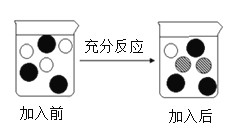
①图中“![]() ”所代表粒子的符号为_______________。
”所代表粒子的符号为_______________。
②充分反应后过滤,滤纸上固体物质是__________________(写化学式); .
③写出该反应的化学方程式_________________。