题目内容
【题目】(1)某元素的原子结构示意图如图所示。
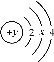
则:
①y=_________;
②该元素的元素符号为_________;
③该元素位于元素周期表的第_________周期。
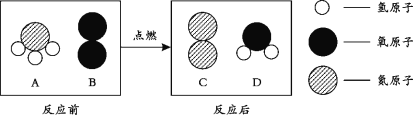
(2)某化学反应的微观示意图如下所示,据图回答问题:

④甲物质中硫元素的化合价为_________;
⑤相同条件下,甲气体的密度比空气密度_________(填“大”或“小”);
⑥丙分子中硫原子和氧原子的质量比是_________;
⑦请写出这个反应的化学方程式:_________。
【答案】14 Si 三(或“3”) -2 大 1∶1 2H2S+3O2=2H2O+2SO2
【解析】
(1)①在原子中,核内质子数等于核外电子数,第二层排满应排8个电子,所以y=2+8+4=14;
②该元素的质子数是14,属于硅元素,元素符号为Si;
③该元素原子的核外有三个电子层,该元素位于元素周期表的第三周期。
(2)由反应的微观示意图可知该反应是硫化氢与氧气反应生成了水和二氧化硫,反应的化学方程式是:2H2S+3O2=2H2O+2SO2。
④甲为硫化氢(H2S)气体,其中氢为+1价,根据化合物中各元素的化合价代数和为零可知,硫元素的化合价为-2价;
⑤甲气体为硫化氢气体,相对分子质量是34,空气的相对分子质量是29,相同条件下,该气体的密度比空气密度大;
⑥丙为二氧化硫,分子中硫原子和氧原子的质量比=32:(16×2)= 1∶1;
⑦由上述分析可知,反应的化学方程式:2H2S+3O2=2H2O+2SO2。

 名校课堂系列答案
名校课堂系列答案【题目】同学们对烧烤用的“锡纸”产生了浓厚兴趣,那么“锡纸”中的金属是什么呢?
(猜想与假设)同学们结合金属的颜色、活动性、价格等因素。猜想:可能是锡、铝、镁、铁中的一种。
(查阅资料)
①氧化铝的熔点 2045℃;
②锡(Sn)与酸或盐溶液反应生成+2 价的锡盐;
③金属锌似晶体状,锌粉是一种深灰色固体,室温下,锌较硬且相当脆。
(初步探究)同学们结合金属的主要的物理和化学特性设计了如下实验:
序号 | 实验方案 | 现象 | 结论 |
1 | _____ | 无明显现象 | 金属不可能是铁 |
2 | 用坩埚钳夹取打磨后的“锡纸”条,放在酒精灯上点燃。 | “锡纸”条熔化但没有滴落,也没燃烧。 | 金属不可能是___ |
(深入探究)同学们对于“锡纸”到底是什么金属。进行了深入的实验探究。
第一组同学:(1)将“锡纸”条卷成和铁钉一样粗细,先在 20%的盐酸中浸泡至产生较多气泡,再取蒸馏水清洗,然后浸在蒸馏水中备用。
(2)将打磨后的铁钉和备用的“锡纸” 条分别放入到装有 5 mL 15%的稀盐酸中,观察到“锡纸”条表面产生的气泡速率比铁钉快。
(实验结论)制作“锡纸”的金属是_____。
第二组同学:取备用 的“锡纸”条放入试管中,滴加_____溶液,“锡纸”表面有深灰色固体析出,也得出和第一组相同的结论,写出它们的化学方程式_________________________。
(交流与反思)
(1)“锡纸”在酒精灯上加热,“锡纸”熔化但没有滴落的原因是_____。
(2)同学们在老师的帮助下,将 3 克烘干的备用“锡纸”片放入装有硫酸锌溶液的试管中,5 分钟后,取出“锡纸”片,洗涤、烘干、称量。反应后金属质量范围是_____。