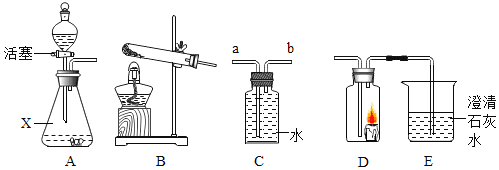
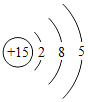题目内容
【题目】如图是甲、乙两种物质的溶解度曲线,请回答下列问题。
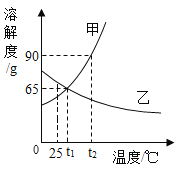
(1)_°C 时,甲、乙两种物质的溶解度相等。
(2)将乙的饱和溶液变成不饱和溶液的方法是_。(任写一种)
(3)t2°C时,分别将甲、乙两种物质的饱和溶液降温到t1°C,有晶体析出的是__,此时甲溶液的溶质质量分数_(填“大于”、“等于”或“小于”)乙溶液的溶质质量分数。
(4)小明同学用20ml 水(密度约为1g/ml )配制t1°C的甲饱和溶液:
①计算需要称量的甲的质量是____g。
②将称取的甲固体和20ml水倒入烧杯中,_(填操作名称),直至固体完全溶解。
【答案】t1 加水或降低温度 甲 大于 13 搅拌
【解析】
(1)据图可以看出,在t1℃时,甲、乙两种物质的溶解度相等,故填:t1;
(2)乙的溶解度随温度的升高而减小,要将乙的饱和溶液变成不饱和溶液可以采用加水或降低温度的方法,故填:加水或降低温度;
(3)甲的溶解度随温度降低而减小,乙的溶解度随温度降低而增大,所以t2℃时,分别将甲、乙两种物质的饱和溶液降温到t1℃,甲有晶体析出;乙的溶解度变大,溶质质量分数与降温前相等,据饱和时质量分数的计算式![]() ×100%,即溶解度越大质量分数也就越大,而t1℃甲的溶解度大于t2℃乙的溶解度,所以此时甲溶液的溶质质量分数大于乙溶液的溶质质量分数。故填:甲;大于;
×100%,即溶解度越大质量分数也就越大,而t1℃甲的溶解度大于t2℃乙的溶解度,所以此时甲溶液的溶质质量分数大于乙溶液的溶质质量分数。故填:甲;大于;
(4)①20ml水即20g水,t1℃时甲的溶解度为65g,即100g水中溶解65g甲刚好可以得到饱和溶液,所以20g水需要甲的质量为65g×![]() =13g。故填:13;
=13g。故填:13;
②将称取的甲固体和20ml水倒入烧杯中,用玻璃棒搅拌,直至固体完全溶解。故填:搅拌。

 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
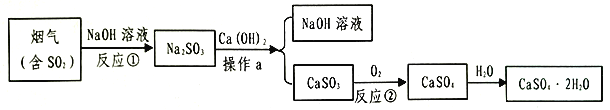
全程金卷系列答案【题目】硼泥主要由MgO 和SiO2 组成,含有少量Fe2O3 、FeO 、Al2O3 等杂质。用硼泥生产氢氧化镁的工艺流程如图所示:
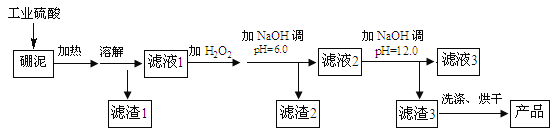
提示信息:
Ⅰ.加入H2O2的目的是将溶液中 Fe2+氧化为 Fe3+
Ⅱ.SiO2不与硫酸反应
Ⅲ.已知某些金属阳离子在溶液中生成氢氧化物沉淀的pH如下表所示,当溶液的pH达到完全沉淀值时,可以认为金属阳离子已完全沉淀。
氢氧化物 | 完全沉淀时的pH |
Mg(OH)2 | 10.8 |
Fe(OH)2 | 9.6 |
Fe(OH)3 | 3.7 |
Al(OH)3 | 4.7 |
(1)写出加热溶解中发生反应的其中一个化学方程式:____。
(2)滤液2中大量存在的金属离子是___。
(3)调节两次pH值的原因是___。
(4)利用Mg(OH)2与含SO2和O2的烟气反应生成MgSO4和另一种无污染的化合物,可以使烟气脱硫,请问另一种产物的化学式为___。
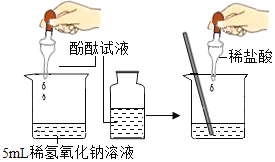
【题目】分类和类比是学习化学常用的方法。
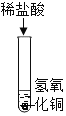
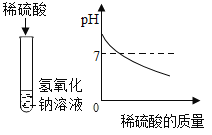
(1)下列实验都能探究酸与碱之间能否发生反应。请从“定性研究”或“定量研究”的角度,将下列实验中的A与_________(填字母)归为一类,理由是_____________。
|
在少量的氢氧化铜固体中加入足量的稀盐酸 |
在氢氧化钠溶液不断滴加稀硫酸,边加边用酸度计测定溶液的pH |
A | B | C |
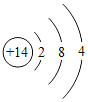
(2)非金属与氢气反应的条件越容易、反应越剧烈,则非金属元素的非金属性越强。据此规律,可推断出第三周期非金属元素的非金属性强弱的顺序为__________________;结构决定性质,请归纳位于第三周期元素的原子结构与元素性质的递变规律______________________。
元素 | Si | p | S | Cl |
单质与氢气的反应条件 | 高温 | 磷蒸气与氢气能反应 | 加热 | 加热或点燃时发生爆炸 |
原子核外电子排布 |
|
|
|
|