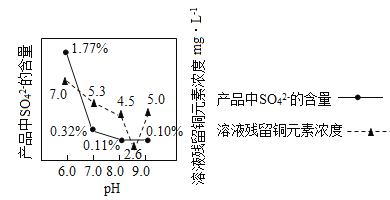
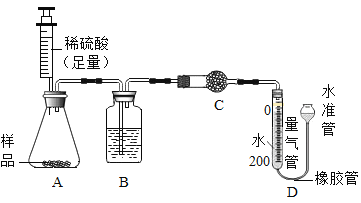
题目内容
甲、乙两种不含结晶水的固体物质的溶解度曲线如图,下列说法中不正确的是
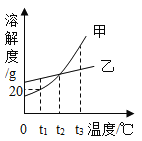
A.t1℃时,50g甲的饱和溶液中溶解了10g的甲
B.将t2℃甲、乙两种物质的饱和溶液升温至t3℃(溶剂的量不变),两种溶液中溶质的质量分数相等
C.t2℃时,要使接近饱和的乙溶液达到饱和状态,可采用蒸发溶剂的方法
D.分别将t2℃甲、乙两种物质的溶液降温至t1℃,一定都有晶体析出
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
某实验小组在做“用澄清石灰水检验二氧化碳”的实验时,发现一个有趣的实验现象:
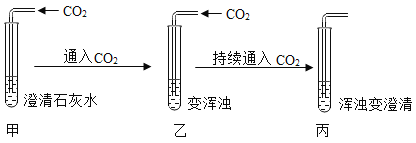
[提出问题]澄清石灰水通入二氧化碳会变浑浊,持续通入二氧化碳,浑浊变澄清,丙试管中溶液的溶质成分是什么?
[查阅资料]
①碳酸钙不溶于水,碳酸钙能与二氧化碳、水反应生成碳酸氢钙[ Ca(HCO3)2]。
②碳酸氢钙易溶于水,受热易分解,生成碳酸钙、二氧化碳、水。
③碳酸氢钙能与氢氧化钠溶液反应生成碳酸钙,能与盐酸反应生成二氧化碳。
[假设与猜想]
猜想1:碳酸钙;
猜想2 :碳酸氢钙和氢氧化钙;
猜想3:只有__________。
[思考与讨论]
同学们认为猜想①一定不正确,理由是____________;小王同学认为猜想2也不正确,理由是___________。
[实验探究]
实验 | 实验步骤 | 实验现象 | 结论 |
一 | 取丙中少量液体于试管中,滴加__ | 有气泡生成 | 猜想3成立 |
二 | 取丙中少量液体于试管中,滴加氢氧化钠溶液 | 有___生成 | |
三 | 取丙中少量液体于试管中,加热 | _________ |
[反思交流]
①由实验可知,反应中产生的现象与______有关;
②试管丙中浑浊变澄清的反应方程式为_____________。



 测定 pH 值 B.
测定 pH 值 B.  点燃酒精灯
点燃酒精灯 取液时挤入空气 D.
取液时挤入空气 D.  稀释浓硫酸
稀释浓硫酸