题目内容
【题目】硫酸是一种重要的化工原料,也是实验室中常用的化学试剂,下面是对硫酸 的组成、性质、制取等方面的探究,请你共同参与并回答有关问题。
(探究一)硫酸的组成
(1)在溶液中解离出的阳离子全部是氢离子的物质统称为酸,检验硫酸中的阴 离子可选择的试剂为_____。
(探究二)硫酸的性质
(2)浓硫酸的特性:用小木棍蘸取少量浓硫酸,放置一会后,可观察到_____。
(3)浓硫酸的稀释:实验室用 98%的浓硫酸配制 100 g 溶质质量分数为 20%的 稀硫酸,应加水的质量为_____g(结果精确到 0.1 g)。
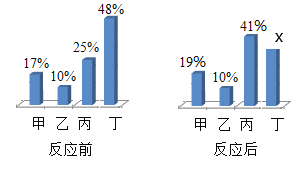
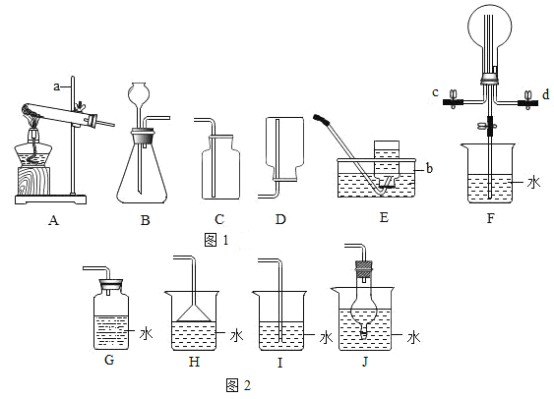
(4)稀硫酸的化学性质:如图为某同学进行的相关实验:
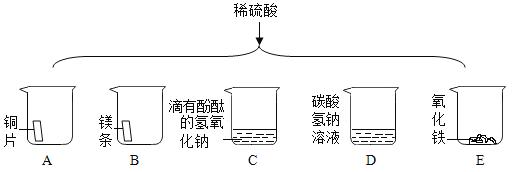
①有气泡产生的是_____(填字母序号)。
②写出烧杯 C 中发生反应的化学方程式_____。
(探究三)硫酸的工业制法
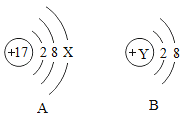
工业上以黄铁矿(主要成分为 FeS2)为原料生产硫酸的工艺流程如图所示:
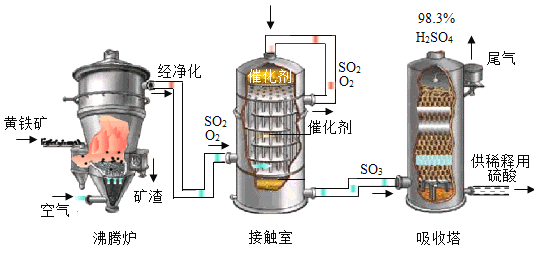
(5)黄铁矿在加入沸腾炉前要进行粉碎,其目的是_____ 。
(6)接触室中发生反应的化学方程式为_____。
(7)依据生产硫酸的工艺流程图,下列说法中正确的是_____ (填字母序号)。
A 吸收塔中得到的产品为混合物
B 催化剂能够加快 SO2 的反应速率和增大 SO3 的产量
C 沸腾炉排出的矿渣可供炼铁
【答案】硝酸钡 小木条变黑 79.6g BD H2SO4+2NaOH=Na2SO4+2H2O 增大反应物的接触面积,加快反应速率 2SO2+O2 2SO3 AC
2SO3 AC
【解析】
[探究一]硫酸的组成
(1)钡离子和硫酸根离子结合生成白色沉淀,通常采用钡离子来检验硫酸根离子,因此检验硫酸中的阴离子可选择的试剂为硝酸钡。故填:硝酸钡。
[探究二]硫酸的性质
(2)浓硫酸具有脱水性,用小木棍蘸取少量浓硫酸,放置一会后,可观察到小木条脱水后变成黑色的碳;故填:小木条变黑。
(3)设稀释前浓硫酸的质量为x。根据稀释前后的溶质质量不变可得:![]() ;解得x
;解得x![]() 20.4g;加水的质量为:100g-20.4g=79.6g。故填:79.6g。
20.4g;加水的质量为:100g-20.4g=79.6g。故填:79.6g。
(4)①烧杯A实验中铜不与稀硫酸反应,无现象;
烧杯B实验中镁和稀硫酸反应生成硫酸镁和氢气,有气泡产生;
烧杯C实验中氢氧化钠和稀硫酸反应生成硫酸钠和水,红色变成无色,无气泡生成;
烧杯D实验中碳酸钠溶液与稀硫酸反应生成硫酸钠、水和二氧化碳气体,有气泡产生;
烧杯E实验中氧化铁与稀硫酸反应生成硫酸铁和水,实验现象是红色固体溶解,溶液有无色变为黄色;
有气泡产生的实验是BD。故填:BD。
②烧杯C中氢氧化钠和稀硫酸反应生成硫酸钠和水,其反应的化学方程式为:H2SO4+2NaOH=Na2SO4+2H2O。故填:H2SO4+2NaOH=Na2SO4+2H2O。
[探究三]硫酸的工业制法
(5)为了使反应物充分接触,反应更快更彻底,节约时间,应将黄铁矿在加入沸腾炉前要进行粉碎,因此粉碎目的是增大反应物的接触面积,加快反应速率。故填:增大反应物的接触面积,加快反应速率。
(6)接触室中通入的是二氧化硫和氧气,在催化剂的作用下反应生成三氧化硫,其反应的化学方程式为:2SO2+O2 2SO3。故填:2SO2+O2
2SO3。故填:2SO2+O2 2SO3。
2SO3。
(7)A、吸收塔中得到的产品是浓硫酸溶液,溶液为混合物,选项说法正确;
B、催化剂能够加快SO2的反应速率,但是不能增大SO3的产量;选项说法错误;
C、沸腾炉排出的矿渣中含有大量的铁元素,可作为炼铁的原材料,选项说法正确。
故填:AC。

 口算题天天练系列答案
口算题天天练系列答案【题目】据有关资料介绍:将贝壳(主要成分是碳酸钙)灼烧后与草木灰(主要成分是碳酸钾)在水中作用,可以得到氢氧化钾.某科学课外小组的同学们为了制取氢氧化钾,将少量碳酸钙充分灼烧后的固体放入烧杯中,再向其中加入一定量10%的碳酸钾溶液,充分反应冷却后过滤、洗涤得到固体A和溶液B,操作步骤如图所示.请你与小组同学共同完成以下探究:
(提出问题1)固体A中的成分是什么?
(猜想与假设)甲同学:只有CaCO3;乙同学:CaCO3、Ca(OH)2
(实验与探究)甲、乙同学为了验证各自的猜想,分别进行了实验:
实验内容 | 实验现象 | 实验结论 |
甲同学:取少量固体于试管中,向其中加入稀盐酸. | 有气泡产生 | 自己的猜 想正确 |
乙同学:取少量固体于试管中,加水充分溶解、过滤, 向滤液中滴加酚酞试液. | 溶液由无色 变为红色 | 自己的猜 想正确 |
(反思与评价)小组同学讨论后认为,甲同学的实验不能证明他的猜想,理由是_____;而乙同学的实验能证明他的猜想,因此小组同学确定了固体A的成分.
(提出问题2)溶液B中溶质的成分是什么?
(猜想与假设)丙同学:KOH、K2CO3 丁同学:KOH、Ca(OH)2
(表达与交流)结合对固体成分的探究,同学们经过讨论确定了丁同学猜想正确,理由是_____.为了得到纯净的氢氧化钾,需要向溶液B中滴加适量的一种溶液,发生反应的化学方程式为_____,小组同学通过相应的实验操作最终制得了氢氧化钾.