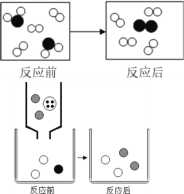
题目内容
【题目】某未知气体X可能含有CO、CH4中的一种或两种,某同学设计实验进行探究。
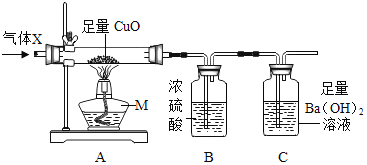
查阅资料:
(Ⅰ)加热时,CH4能与CuO反应生成一种红色金属单质、能灭火的气体和式量最小的氧化物;
(Ⅱ)20℃时,Ca(OH)2和Ba(OH)2溶解度分别为:0.165g,2.1g
(1)仪器M的名称是_____,CH4与CuO反应的化学方程式为_____。
(2)气体X成分的猜想与探究
猜想1:只有CO
猜想2:只有CH4
猜想3:既有CO又有CH4
①实验时,先往装置中通一段时间的N2,再通入气体X后加热,实验中有下列变化:变化1:A中玻璃管内黑色粉末逐渐变红,变化2:B瓶增重。变化3:C中出现浑浊。根据变化_____(填“1”“2”或“3“),可知猜想1不成立。
②根据上述变化仍无法确定气体X的成分,还需要测定_____(填序号),并进行定量分析才能得出结论。
a 实验前A中CuO的质量 b B瓶增重的质量 c C瓶增重的质量
(3)讨论和反思:
C中用Ba(OH)2溶液而不用Ca(OH)2溶液的原因是_____。
【答案】酒精灯 ![]() 2 abc 室温条件下氢氧化钡的溶解度远大于氢氧化钙,便于把二氧化碳全部吸收
2 abc 室温条件下氢氧化钡的溶解度远大于氢氧化钙,便于把二氧化碳全部吸收
【解析】
加热条件下,CH4与CuO反应生成铜、二氧化碳和水,一氧化碳和氧化铜反应生成铜和二氧化碳;
浓硫酸能够吸收水蒸气,氢氧化钙溶液、氢氧化钡溶液可以吸收二氧化碳。
解:(1)仪器M的名称是酒精灯,CH4与CuO反应生成铜、二氧化碳和水,反应的化学方程式为:4CuO+CH4![]() 4Cu+CO2+2H2O。
4Cu+CO2+2H2O。
故填:酒精灯;4CuO+CH4![]() 4Cu+CO2+2H2O。
4Cu+CO2+2H2O。
(2)①根据变化2,即B瓶增重可知反应生成了水,进一步可知气体中含有甲烷,可知猜想1不成立。
故填:2。
②根据上述变化仍无法确定气体X的成分,还需要测定实验前A中CuO的质量和B、C瓶增重的质量,即通过氧化铜质量可以计算其中氧元素质量,再根据生成水的质量可以计算氧化铜和甲烷反应生成二氧化碳的质量,再吧二氧化碳质量和C中增加质量比较,如果相等,则气体中不含有一氧化碳,如果小于C中增加的质量,则气体中含有一氧化碳。
故填:abc。
(3)C中用Ba(OH)2溶液而不用Ca(OH)2溶液的原因:室温条件下氢氧化钡的溶解度远大于氢氧化钙,便于把二氧化碳全部吸收。
故填:室温条件下氢氧化钡的溶解度远大于氢氧化钙,便于把二氧化碳全部吸收。

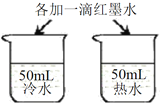
【题目】下列实验设计能达到实验主要目的是( )
选项 | 实验目的 | 实验设计 | 选项 | 实验目的 | 实验设计 |
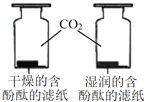
A | 探究CO2与水反生反应 |
| B | 探究水对铁钉锈蚀的影响 |
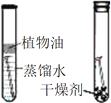
|
C | 探究空气是燃烧的必要条件 |
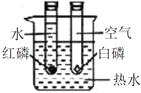
| D | 探究温度对分子运动快慢的影响 |
|
A. AB. BC. CD. D