题目内容
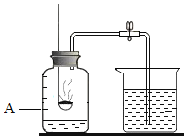
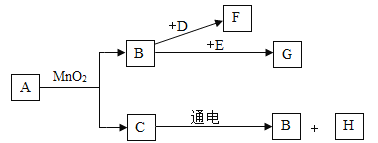
【题目】有A、B、C、D 四种物质。①A是无色气体,能使带火星的木条复燃;②B为暗红色粉末,在空气中能剧烈燃烧产生大量白烟;③C能在A中燃烧发出蓝紫色火焰;④某银白色金属在A中能剧烈燃烧,火星四射,放出大量的热,生成黑色固体D。据此完成下列空白:
(1)写出下列物质的名称或化学式:A ____ ;B_____; C______ ;D_______。
(2)写出③④中反应的化学方程式: ____________; ___________。
【答案】氧气(O2)红磷(P)硫(S)四氧化三铁(Fe3O4)S+O2![]() SO23Fe+2O2
SO23Fe+2O2![]() Fe3O4
Fe3O4
【解析】
(1)A是无色气体,能使带火星的木条复燃,故A为氧气,化学式为O2;B为暗红色粉末,在空气中能剧烈燃烧产生大量白烟,符合红磷燃烧的现象,故B为红磷,化学式为P;C能在A中燃烧发出蓝紫色火焰,符合硫在氧气中燃烧的现象,故C为硫,化学式为S;某银白色金属在A中能剧烈燃烧,火星四射,放出大量的热,生成黑色固体D,符合铁在氧气中燃烧的现象,故D为四氧化三铁,化学式为Fe3O4;
(2)③硫在氧气中燃烧生成二氧化硫,化学方程式为S+O2![]() SO2;④铁在氧气中燃烧生成四氧化三铁,化学方程式为3Fe+2O2
SO2;④铁在氧气中燃烧生成四氧化三铁,化学方程式为3Fe+2O2![]() Fe3O4
Fe3O4

【题目】云通过探究发现,氯酸钾与氧化铜(CuO)、氧化铁(Fe2O3)混合加热,也能较快产生氧气,于是进行如下探究:
(查阅资料)氯酸钾的熔点为356℃,常温下稳定,在400℃以上则分解产生氧气。酒精灯加热温度为400℃~500℃。
(提出猜想)除MnO2、CuO外,Fe2O3也可以作氯酸钾分解的催化剂。
(完成实验)按下表进行实验并测定分解温度。
实验编号 | 实验药品 | 分解温度 |
1 | 3.0g氯酸钾 | 460℃ |
2 | 3.0g氯酸钾和0.5g二氧化锰 | 248℃ |
3 | 3.0g氯酸钾和0.5g氧化铜 | 267℃ |
4 | 3.0g氯酸钾和Xg氧化铁 | 290℃ |
(分析数据,得出结论)
(1)实验3的化学反应式:______________________。
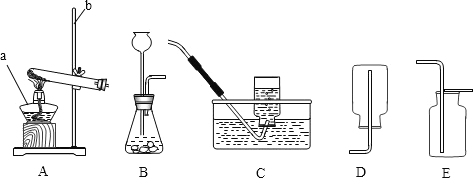
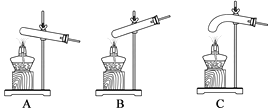
(2)小云从下图中选择该实验的最佳发生装置是__________。
(3)实验4中X的值应为__________,由实验__________与实验4对比,证明猜想合理。
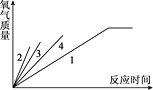
(4)通过实验测得的数据,小云绘出了部分下图,请帮他完成该图。
(结论)通过该实验探究中,得到的结论有__________(填序号)。
A.催化剂可降低反应温度
B.二氧化锰只能催化氯酸钾的分解
C.催化剂的质量和性质在反应前后不变
D.催化剂可改变产物的质量
E.三种催化剂中,二氧化锰对氯酸钾分解催化效果最好