题目内容
【题目】盐酸是氯化氢气体的水溶液,工业上用途非常广泛。盐酸是胃酸的主要成分,它能促进食物消化,抵御微生物感染。
(1)工业上常用稀盐酸来除铁锈,写出化学方程式_____。
(2)①如图所示,小明进行盐酸和氢氧化钠的酸碱中和实验,根据图示可知,小明是把_____加入到了另外一种溶液中。
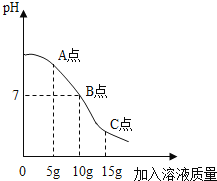
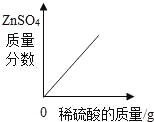
②写出A处溶液中溶质的化学式_____。从B点到C点,氯化钠的质量分数逐渐_____(填“增大”“减小”或“不变”)。
(3)氢氧化钠溶液与稀盐酸反应过程中无明显的现象,为了使氢氧化钠溶液与稀盐酸恰好完全反应,应该如何操作_____?
(4)为探究盐酸与金属反应的规律,某实验小组进行了如下实验:取等质量、同形状的铁片、镁片、锌片,分别与等体积、等浓度的稀盐酸反应,用温度传感器测得反应温度变化曲线如下图所示。

①写出铁与稀盐酸反应的化学方程式_____。
②请分析反应中温度升高的原因_____。
【答案】![]() 稀盐酸 NaOH、NaCl 减小 在盛有氢氧化钠溶液的试管中滴入酚酞溶液,然后慢慢滴入稀盐酸,边滴边振荡,当溶液的颜色恰好由红色变为无色时,停止滴入稀盐酸,此时氢氧化钠溶液与稀盐酸恰好完全反应。
稀盐酸 NaOH、NaCl 减小 在盛有氢氧化钠溶液的试管中滴入酚酞溶液,然后慢慢滴入稀盐酸,边滴边振荡,当溶液的颜色恰好由红色变为无色时,停止滴入稀盐酸,此时氢氧化钠溶液与稀盐酸恰好完全反应。 ![]() 金属与稀盐酸反应时放出热量
金属与稀盐酸反应时放出热量
【解析】
(1)盐酸和氧化铁反应生成氯化铁和水,反应的化学方程式:![]() ;
;
(2)①盐酸呈酸性,而氢氧化钠溶液呈碱性,根据图中信息可以知道起始溶液呈碱性,所以可以判断是将稀盐酸滴入氢氧化钠溶液中;
②从图中可以判断当加入溶液为5g时,溶液呈碱性,即加入的盐酸量不足,而氢氧化钠和盐酸反应生成了氯化钠,所以此时溶液中的溶质为:氯化钠和氢氧化钠;B点是氢氧化钠和盐酸恰好完全反应生成氯化钠和水,B点后氯化钠的质量不变,随着盐酸不断加入,溶液的质量不断增大,所以氯化钠的质量分数减小;
(3)为了使氢氧化钠溶液与稀盐酸恰好完全反应,设计如下实验:向加有酚酞试液的氢氧化钠溶液中逐滴加入稀盐酸,若观察到溶液恰好由红色变为无色,则证明二者恰好完全中和;
(4)①铁与稀盐酸反应生成氯化亚铁和氢气,反应的化学方程式![]() ;
;
②反应过程中温度升高的原因:金属单质和酸反应放热。

 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案【题目】某实验小组为确定一瓶久置的碱石灰![]() 生石灰和氢氧化钠固体的混合物
生石灰和氢氧化钠固体的混合物![]() 样品的成分,进行了如下实验:取少量碱石灰样品于烧杯中,向其中加入足量水,充分溶解后,过滤,得到固体A和溶液B,并对固体A和溶液B的成分展开了探究活动。
样品的成分,进行了如下实验:取少量碱石灰样品于烧杯中,向其中加入足量水,充分溶解后,过滤,得到固体A和溶液B,并对固体A和溶液B的成分展开了探究活动。
探宄活动一:固体A的成分是什么?
(实验验证)取一定量固体A于试管中,滴加稀盐酸,有气泡产生。固体A中一定含有______![]() 填化学式
填化学式![]() 。
。
探究活动二:探究溶液B中溶质成分是什么?
(猜想与假设)猜想①; NaOH;猜想②:![]() ;猜想③:NaOH和
;猜想③:NaOH和![]() ;猜想④:NaOH和______。
;猜想④:NaOH和______。
(实验探究)小明、小强同学分别进行如下实验并得出相应的结论:
小明同学:取少量溶液B于试管中,滴加几滴酚酞溶液,溶液变成红色,则溶液B中溶质一定含有NaOH。
小强同学:取少量溶液B于试管中,滴加足量的稀盐酸,产生大量气泡,则溶液B中溶质是![]() 。
。
(反思与评价)同学们认真分析上述两位同学的实验,认为他们的结论均有不足之处,不能确定溶液B中溶质的成分,请指出小明同学结论的不足之处是______。为进一步确认溶液B中溶质的成分,同学们继续做了如下实验。
实验步骤 | 实验现象 | 实验结论 |
步骤Ⅰ:取少量溶液B于试管中,加入 ______ | 有白色沉淀生成 | 猜想③正确 |
步骤Ⅱ:取步骤Ⅰ中上层清液少许于试管中,向其中滴加硝酸铜溶液。 | ______ |
(反思与拓展)
实验过程中,同学们发现向样品中加水时还放出大量的热。综合以上探究,下列对碱石灰样品成分分析正确的是______![]() 填字母序号
填字母序号![]() 。
。
A 一定含有NaOH
B 一定含有![]()
C 一定含有CaO
D 至少含有NaOH、CaO中的一种
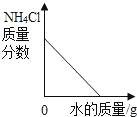
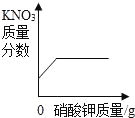
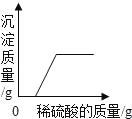
【题目】下列图象与所述实验相符的是( )
A | B | C | D |
向一定量锌粒中加入过量稀硫酸 | 向一定量氯化铵饱和溶液中不断加入水 | t℃时,向一定量不饱和的硝酸钾溶液中不断加入硝酸钾晶体 | 向一定量氢氧化钠和氢氧化钡的混合溶液中加入稀硫酸 |
|
|
|
|
A. AB. BC. CD. D