题目内容
【题目】质量守恒定律的发现对化学的发展作出了重要贡献。
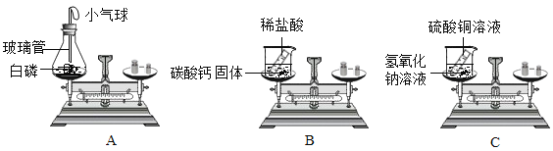
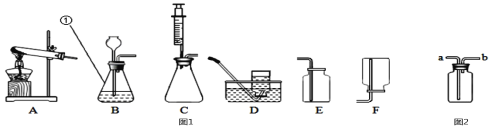
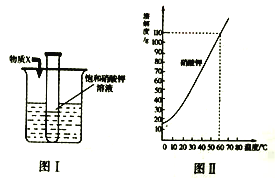
(1)用如图所示的3个实验验证质量守恒定律,其中实验前后天平不能保持平衡的是______(填序号),理由是_________。
(2)从微观角度分析有助于我们理解质量守恒定律,在一密闭容器内有4种物质A、B、C、D,它们在一定条件下发生燃烧的反应,经过一段时间后停止反应,其中A、B、C、D的微观示意图和反应前后各物质的质量如表所示。
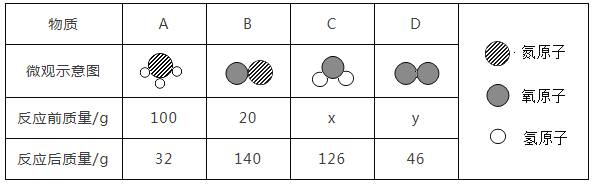
①从微观角度分析,化学反应中质量守恒的原因是______。
②该反应中B和C的质量比为_____。
③表中x的值是______。
(3)1756年,俄国化学家罗蒙诺索夫曾开展的实验:先用天平称取质量为m1的金属锡粉(Sn)。将锡粉放在密闭容器里进行完全燃烧生成了白色固体物质,称量容器的总质量为m2。打开容器,听到了空气进入容器发出的“丝丝的声响”,待容器中空气恢复到初始状态,重新称量容器的总质量为m3。
①锡的常见化合价为+4,则锡的燃烧化学方程式是_________。
②罗蒙诺索夫分析数据后发现,生成白色物质的质量________(用含m1m2m3代数式表示)。
【答案】B 反应有CO2逸出 化学反应前后原子的种类、数目、质量不变 10:9 18 Sn+O2![]() SnO2 m1+m3-m2
SnO2 m1+m3-m2
【解析】
(1)分析三个实验可以知道,反应A中是在密闭的容器中反应,B是在敞口的容器中反应且生成了气体逸出,导致左盘中容器内的物质总质量减少;C虽然是敞口的容器中反应但是没有生成气体,所以可以判断反应前后B实验前后天平不能保持平衡,理由是反应有CO2逸出;
(2)①根据化学反应的实质可以知道,在反应的过程中是分子裂解成原子,原子进行了重新组合而得到新的分子,所以该过程中原子的种类、原子的数目和原子的质量都没有发生改变,化学反应前后质量守恒;
②根据表格中的信息可以知道,反应前后B的质量增加了,所以B为生成物,反应中生成的质量=(140g-20g)=120g,反应前后A物质的质量减少了,所以A为反应物,参加反应的A的质量=(100g-32g)=68g,结合反应前后元素的种类不变可以知道,反应物为A和D,生成物为B和C,其中A为NH3,B为NO,C为H2O,D为O2,可以写出该反应的化学方程式为:4NH3+5O2![]() 4NO+6H2O;反应中物质的质量比等于它们的相对分子质量乘以化学计量数的比,所以可以知道B和C的质量比为:120:108=10:9;
4NO+6H2O;反应中物质的质量比等于它们的相对分子质量乘以化学计量数的比,所以可以知道B和C的质量比为:120:108=10:9;
③根据上述的解答可以知道,反应中生成B的质量为:140g﹣20g=120g, B:C=10:9,所以可以判断反应中生成C的质量为108g,即126﹣x=108,所以x=18;
(3)①锡粉放在密闭容器里进行完全燃烧,生成了白色固体物质二氧化锡,化学反应方程式是Sn+O2 ![]() SnO2;
SnO2;
(2)将这些锡粉放在密闭容器里进行完全燃烧,生成了白色固体物质,称量容器的总质量为m2。把白色物质放回原容器里(容器中空气的组成恢复到初始状态),重新称量容器的总质量为m3,则参加反应的气体的质量为m3﹣m2,生成白色物质的质量=m 1+m3﹣m2。

【题目】根据下面信息,回答问题。
(1)不同实验对反应速率有不同要求。某同学探究CO2制取实验,按要求答题。限选控制反应速率的方法: ①反应物的浓度 ②反应物的状态
限选试剂:A.稀盐酸 B.浓盐酸 C块状石灰石D.碳酸钠溶液E.粉末状石灰石
填写下表并回答相关问题:
实验名称 | 控制速率的方法 | 所选用的最佳试剂 |
灭火器反应原理 | ______和D | |
CO2的实验室制法 | ______________ | A和C |
写出灭火器反应原理的化学方程式:________________
(2)已知:CO2和SO2既有相似性,又有差异性。
实验一:水槽中滴入紫色石蕊溶液,将收集满的两种气体的试管同时倒立于其中,片刻后实验现象如图所示,说明相同条件下的溶解性:SO2___(填“>”或“<")CO2,试管内溶液变成__________色。
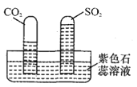
实验二:已知镁条在CO2中剧烈燃烧的化学方程式为2Mg+CO2![]() 2MgO+C试推测镁条在SO2中燃烧的化学方程式为:___________________。
2MgO+C试推测镁条在SO2中燃烧的化学方程式为:___________________。