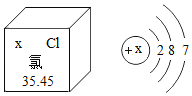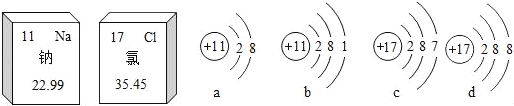题目内容
【题目】下图一是非金属元素形成微粒的结构示意图。该非金属单质可以用多种方法制得,下图二为其中一种制法的反应的微观示意图。
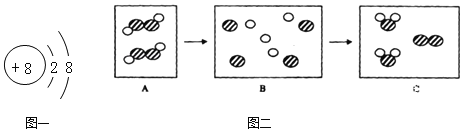
请根据以上信息回答问题:
(1)该非金属元素的原子最外层电子数=_____;图一所示的微粒的符号为_____.
(2)写出与图二相符的反应的化学方程式_____.
【答案】6 O2- 2H2O2![]() 2H2O+ O2↑
2H2O+ O2↑
【解析】
(1)由图知,该非金属元素的原子核内有质子8个,根据原子核外电子排布的规律,第1层最多排2个电子,排满第1层再排第2层,所以该原子的最外层电子数为6,图一所示的微粒为氧的离子,所以符号为O2-,故填:6 O2-;
(2)图二的反应物是由各两个两种原子构成的分子,过氧化氢分子的构成与之相似,生成物的构成与水分子和氧分子相似,所以可表示为2H2O2![]() 2H2O+ O2↑,故填:2H2O2
2H2O+ O2↑,故填:2H2O2![]() 2H2O+ O2↑。
2H2O+ O2↑。

【题目】牙膏是一种日用必需品。某研究性学习小组对某一品牌牙膏中所含摩擦剂的成分进行了如下探究。
[查阅资料]
(1)牙膏常用氢氧化铝、碳酸钙、二氧化硅等物质作摩擦剂,牙膏中其它成分遇到盐酸时无气体生成;SiO2不溶于水也不与盐酸反应。
(2)氢氧化铝是两性氢氧化物,在常温下它既能与强酸,又能与强碱反应。如与氢氧化钠可发生如下反应:Al(OH)3+NaOH=NaAlO2+2H2O.(NaAlO2溶于水)
[提出问题]该品牌牙膏的酸碱性如何?其中含有什么摩擦剂?
[实验与猜想]
(1)取少量牙膏膏体于小烧杯中,加入10毫升蒸馏水,充分搅拌,静置一段时间,分离上层清液和沉淀,待用;
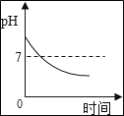
(2)用pH试纸测定所得溶液的pH大于7,正确的操作方法是_____。
(3)取少量沉淀物加入过量的稀盐酸,沉淀物全部溶解并有大量气泡产生,同时得到澄清溶液A,则该品牌牙膏中一定含有碳酸钙,一定不含有_____。
(4)进行猜想:摩擦剂成分可能是a。只含碳酸钙 b._____。
[设计实验]
实验步骤 | 实验现象 | 解释与结论 |
取澄清溶液A逐滴滴入一定量氢氧化钠溶液 | 开始无明显现象,后产生白色沉淀 | 原因是1._____,2._____。(用化学方程式表示) |
继续滴入氢氧化钠溶液直至过量 | _____ | 摩擦剂中还含有_____ |
[实验结论]该品牌牙膏所含摩擦剂的成分猜想b正确。
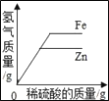
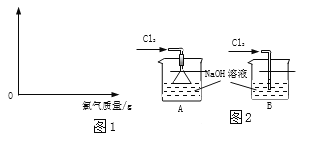
【题目】用煤直接做燃料如果不进行处理,会因煤中的硫生成SO2气体造成大气污染。
(1)现有南方产的一种煤含硫8%。某火力发电厂燃烧100t这种煤,假设燃烧时煤中的硫全部转化为SO2,则产生SO2的质量是________?
(2)如在煤中混入粉末状的石灰石,则燃烧产生的SO2会与CaCO3反应生成CaSO3进入炉渣而减少大气污染。取50g此炉渣(含24%CaSO3)逐滴加入20%的盐酸,请在图坐标中画出相应的曲线图(纵坐标为盐的质量,请设定具体物质;并标出曲线中必要的数据)。
 ________________
________________
[已知]①设炉渣已不含石灰石,炉渣其它成分不与盐酸反应;
②CaSO3和盐酸反应类似于CaCO3
(3)向燃烧后的烟气喷洒石灰浆也可吸收SO2生成CaSO3。现用一万元分别购买两种原料来除去SO2,相关数据如下表:
方法 | 物质 | 相对分子质量 | 纯度 | 价格(元/t) | 除SO2的量(t) |
A | 石灰石 | 100 | 90% | 200 | 14.4 |
B | 熟石灰 | 74 | 94% | 500 | 14.6 |
方法B比方法A除SO2的量略大,而且工业上多数采用方法B。其原因分别是:_________。
【题目】某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究.
[查阅资料]
<资料1>该厂采用“侯氏制碱法”生产的化工产品为纯碱(化学式为_____)和氯化铵.(“侯氏制碱法”是我国近代著名科学家侯德榜发明的一种连续生产纯碱与氯化铵的联合制碱工艺.)
<资料2>生产原料粗盐中含有少量可溶性杂质(MgCl2和CaCl2)及不溶性杂质.
<资料3>部分生产流程如下图所示.
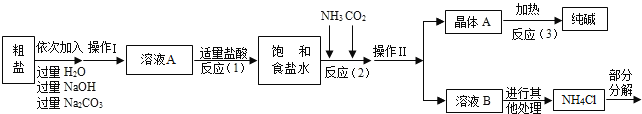
上述流程中涉及的部分反应的化学方程式为:MgCl2+2NaOH=Mg(OH)2↓+2NaCl;Na2CO3+CaCl2=CaCO3↓+2NaCl;NH4Cl═NH3↑+HCl↑
生产原理:将氨气(NH3)和二氧化碳通入饱和食盐水中得到小苏打和氯化铵的混合物,其反应的化学方程式为:NaCl(饱和溶液)+NH3+CO2+H2O=NaHCO3(晶体)↓+NH4Cl;分离出NaHCO3,使其充分受热即可分解制得纯碱及两种常见的氧化物,此反应的化学方程式为_____.
(问题讨论)
(1)溶液A中的溶质为_____,操作Ⅱ的名称为_____.
(2)上述生产流程中可循环使用的是_____(填序号).
ACO2BNH3C.HCl DNaOH ENa2CO3
(3)根据上述信息,请你设计实验区分碳酸钠和碳酸氢钠.
实验步骤 | 实验现象 | 实验结论 |
_____ | _____ | _____ |
(含量测定)
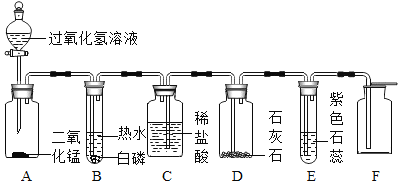
同学们为了测定该纯碱样品的纯度,设计了如下实验.
甲组:取10.0g纯碱样品(假定杂质在整个实验过程中不发生变化),向其中加入过量的盐酸,直至样品中无气泡冒出.充分加热蒸发所得物质并干燥、冷却至室温后称量,所得固体质量为10.9g.样品中碳酸钠的质量分数为_____(结果保留一位小数).
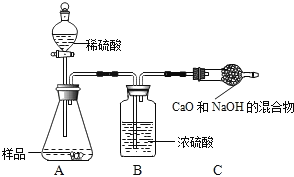
乙组:取10.0g纯碱样品,利用右图所示装置,测出反应后装置C增重了3.5g(所加试剂均足量).
实验结束后,发现乙组测定的质量分数偏小,其原因是_____.