题目内容
【题目】氯碱工业是最基本的化学工业之一,是指工业上用电解饱和NaCl溶液的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品。反应原理是:
2NaCl + 2H2O![]() 2NaOH + Cl2↑ + H2↑
2NaOH + Cl2↑ + H2↑
(1)工业上电解浓度为26.5%的饱和工业盐水200t,则生产氯气的质量是多少_____?(精确到0.1)
(2)取电解生产的氯气71g,通入到一定浓度的NaOH溶液中制备漂白液(主要成分为盐NaClO),反应原理为:Cl2 + 2NaOH = NaClO + NaCl + H2O。请在图1坐标中画出相应的曲线图(纵坐标为盐的质量,请设定具体物质,并标出曲线中必要的数据_____)。
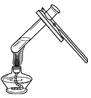
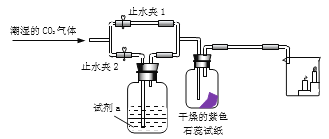
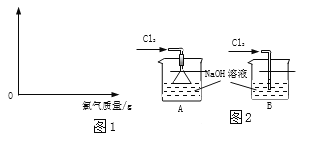
(3)图2是实验室制备漂白液的部分装置。最好选用的装置是_____(填序号),理由_____。
【答案】32.2t 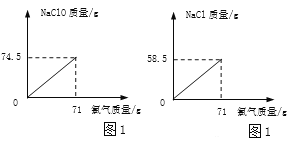 A 吸收反应充分(吸收效率高),防止倒吸
A 吸收反应充分(吸收效率高),防止倒吸
【解析】
根据反应的化学方程式结合数据进行解答即可。
解(1)设生成氯气的质量为x,26.5%的饱和工业盐水200t中含有氯化钠的质量=200t![]() 26.5%=53t,则:
26.5%=53t,则:

![]()
x=32.2t;
(2)设吸收氯气71g,生成NaClO的质量为m,NaCl 的质量为n,则:

![]() m=74.5g,
m=74.5g,
![]() n=58.g,
n=58.g,
根据以上数据,曲线如图: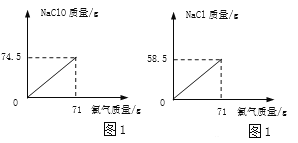 ;
;
(3)使用漏斗能使氯气充分接触氢氧化钠溶液,充分吸收。

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案
相关题目