题目内容
【题目】小明同学欲通过实验证明“二氧化锰是氯酸钾受热分解的催化剂”这一命题.他设计并完成了下表所示的探究实验:
实验操作 | 实验现象 | 实验结论或总结 | ||
各步骤结论 | 总结 | |||
实验 一 | 将氯酸钾加热至融化,伸入带火星的木条 | 木条复燃 | 氯酸钾受热分解产生氧气,但____________, 反应的文字表达式:___________________ | 二氧化锰是氯酸钾 受热分解的催化剂 |
实验二 | 加热二氧化锰,伸入带火星的木条 | 木条不复燃 | 二氧化锰受热不产生氧气 | |
实验三 | ____________ | 木条迅速复燃 | 二氧化锰能加快氯酸钾的分解 | |
(1)请你帮助小明同学填写上表中未填完的空格;
(2)在小明的探究实验中,实验一和实验二起的作用是_____;
(3)小英同学认为仅由上述实验不能完全得出表内“总结”,她补充设计了 两个方面的探究实验,最终完成了对“命题”的实验证明.
第一方面的实验操作中包含了两次称量,其目的是_____;
第二方面的实验是要_____(写实验目的).
第二方面的实验目的已经明确,如何设计实验加以证明?请写出实验步骤,现象,结论:
步骤:_____.
现象:_____.
结论:_____.
【答案】反应速度很慢 氯酸钾![]() 氯化钾+氧气 将氯酸钾和二氧化锰一起加热 对比(或对照) 证明在反应前后二氧化锰的质量没有发生变化 验证反应前后二氧化锰的化学性质是否发生改变 准确称取一定质量的二氧化锰和少量氯酸钾混合后放入试管中,加热,用带火星的木条试验,可知片刻后有大量氧气放出,加热到无氧气放出后,再向试管中加入少量的氯酸钾,继续用带火星的木条试验 产生氧气的速率仍很快 反应前后二氧化锰的化学性质不变
氯化钾+氧气 将氯酸钾和二氧化锰一起加热 对比(或对照) 证明在反应前后二氧化锰的质量没有发生变化 验证反应前后二氧化锰的化学性质是否发生改变 准确称取一定质量的二氧化锰和少量氯酸钾混合后放入试管中,加热,用带火星的木条试验,可知片刻后有大量氧气放出,加热到无氧气放出后,再向试管中加入少量的氯酸钾,继续用带火星的木条试验 产生氧气的速率仍很快 反应前后二氧化锰的化学性质不变
【解析】
利用催化剂的特点与催化作用,以及实验室中制取氧气的反应原理来解答此题.在验证二氧化锰的催化作用时,可设计对比实验,利用对比实验说明二氧化锰能加快反应的速度,且反应前后二氧化锰的质量和化学性质保持不变。
(1)实验一:单独加热氯酸钾制取氧气需要的温度较高,单独加热二氧化锰没有氧气生成,加热二者的混合物能在较低的温度下释放出氧气;
故答案为:
实验操作 | 实验现象 | 实验结论或总结 | ||
各步骤结论 | 总结 | |||
实验一 | 将氯酸钾加热至融化,伸入带火星的木条 | 木条复燃 | 氯酸钾受热分解产生氧气,但 反应速度很慢, 反应的文字表达式: 氯酸钾 | 二氧化锰是氯酸钾受热分解的催化剂 |
实验二 | 加热二氧化锰,伸入带火星的木条 | 木条不复燃 | 二氧化锰受热不产生氧气 | |
实验三 | 将氯酸钾和二氧化锰一起加热 | 木条迅速复燃 | 二氧化锰能加快氯酸钾的分解 | |
(2)实验一和实验二起的作用是对比(或对照等),验证二氧化锰的作用;故填:对比(或对照);
(3)小明同学进行了实验操作中包含了两次称量,其目的是检验反应前后二氧化锰的质量是否改变;还需要检验反应前后二氧化锰的化学性质是否改变.设计实验:准确称取一定质量的二氧化锰和少量氯酸钾混合后放入试管中,加热,用带火星的木条试验,可知片刻后有大量氧气放出,加热到无氧气放出后,再向试管中加入少量的氯酸钾,继续用带火星的木条试验,发现产生氧气的速率仍很快,由此证明反应前后二氧化锰的化学性质不变.
故填:证明在反应前后二氧化锰的质量没有发生变化;验证反应前后二氧化锰的化学性质是否发生改变;准确称取一定质量的二氧化锰和少量氯酸钾混合后放入试管中,加热,用带火星的木条试验,可知片刻后有大量氧气放出,加热到无氧气放出后,再向试管中加入少量的氯酸钾,继续用带火星的木条试验;产生氧气的速率仍很快;反应前后二氧化锰的化学性质不变.

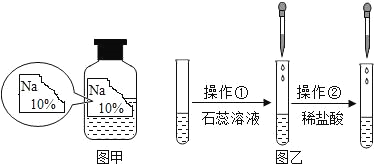
【题目】(一)某同学在实验室发现了一瓶标签残缺的无色溶液﹙如图甲所示﹚,为确认其中的溶质,他设计并进行了如下探究活动,请回答下列问题。
(猜想与假设)
其溶质可能为NaCl、NaOH、Na2CO3和NaHCO3中的一种。
(资料查阅)上述四种物质的相关信息如下:
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
常温下的溶解度/g | 36 | 109 | 21.5 | 9.6 |
常温下某稀溶液的pH | 7 | 13 | 11 | 9 |
(探究过程)
如图乙所示,在操作①后可确定溶质不是NaCl,则实验过程和实验现象应是_____;在进行操作②时有无色无味得到气体产生,由此又可排除假设物质中的_____。
(探究结论)
你认为该溶液中的溶质可能是上述假设物质中的_____,你的判断依据是_____。
(探究反思)
(1)若上述探究结论是正确的,操作②产生的气体应是_____(写化学式),实验室检验该气体的实验操作及现象是_____。
(2)另有同学猜想其中的溶质还可能是Na2SO4,但又没有Na2SO4的上述表列信息。
请你根据以上实验操作的相关现象,判断该溶液中的溶质是否是Na2SO4,并叙述理由:_____。
(二)兴趣小组的同学在做镁条和盐酸反应实验时发现,试管外壁很烫,试管口出现白雾。白雾是什么呢?
Ⅰ.同学们作出猜想
猜想一:是小水滴。因为盐酸溶液中的水受热会汽化上升,在试管口_____(填物态变化名称)成小水滴。
猜想二:是盐酸小液滴。因为浓盐酸具有_____性,可能实验中使用的盐酸浓度过高,试管口就会形成盐酸小液滴。
同学们将干燥的蓝色石蕊试纸放在内有正在反应的镁条和盐酸的试管口,试纸变红,证明猜想二是合理的。
Ⅱ.小柯提出质疑
为什么刚才打开盛放实验所用盐酸的试剂瓶,瓶口没有白雾,却在反应过程中出现白雾?
小柯联系反应时试管外壁很烫,于是猜想:白雾的形成可能与温度有关。
他用试管取少量盐酸,将干燥的蓝色石蕊试纸放在试管口,试纸不变红;然后_____(填操作),试纸变红。
得出结论:这种盐酸浓度并不高,是因_____促使盐酸形成白雾。
【题目】小明同学欲通过实验证明二氧化锰是氯酸钾受热分解的催化剂.他设计并完成了下表所示的探究实验
实验操作 | 实验现象 | 实验结论或总结 | ||
实验结论 | 实验总结 | |||
实验一 | 氯酸钾在试管中加热, ①融化前伸入带火星的木条; ②融化后继续加热,再伸入带火星的木条, | ①木条不复燃 ②木条复燃 | 氯酸钾加热产生氧气反应的化学方程式为:________________ | 二氧化锰是氯酸钾受热分解的催化剂 |
实验二 | 加热二氧化锰,伸入带火星的木条, | 木条不复燃 | 二氧化锰受热不产生氧气. | |
实验三 | 木条迅速复燃 | 二氧化锰能加快氯酸钾的分解 | ||
(1)请你帮小明同学填写上表中未填完的空格;
(2)实验一中①②说明了什么?_____.
(3)在小明的探究实验中,实验一和实验二的作用是_____.
(4)小英同学认为仅由上述实验还不能完全得出表内“总结”,她补充设计了两个探究实验,最终通过实验,完整地证明了二氧化锰是氯酸钾受热分解的催化剂.第一个的实验操作中包含了两次称量,其目的是:_____;第二个的实验是要_____.