题目内容
(2011?呼伦贝尔)食醋是家庭厨房中常备的一种酸性调味品,其溶质的质量分数越大,溶液酸性越强.(1)在常温下,3%的食醋的pH(填“大于”、“小于”或“等于”)4%的食醋的pH,要使食醋的pH升高,可采用的方法是;
(2)生活中许多物质能与食醋发生化学反应,请你选择两种不同类别的物质填写在后面的横线上.
【答案】分析:(1)对于酸性溶液来说PH越大酸性越弱,溶质质量分数越大酸性越强.
(2)利用生活常识结合酸的共性对题目进行分析即可.
解答:解:(1)酸性溶液溶质质量分数越大酸性越强,所以减低酸性应对溶液进行稀释,由于酸的PH值是越大酸性越弱所以3%的食醋的pH 大于4%的食醋的pH;
故答案为:大于,加水稀释(加入更低浓度的醋酸溶液、加热蒸发等.)
(2)生活中的物质中碳酸盐、金属都可与酸反应,因此也会与醋酸反应.
故答案为:碳酸钠、铝、氢氧化钙等.
点评:此题是一道生活实际考查题,解题的关键是能对酸性的PH特点以及改变酸性的方法的掌握.
(2)利用生活常识结合酸的共性对题目进行分析即可.
解答:解:(1)酸性溶液溶质质量分数越大酸性越强,所以减低酸性应对溶液进行稀释,由于酸的PH值是越大酸性越弱所以3%的食醋的pH 大于4%的食醋的pH;
故答案为:大于,加水稀释(加入更低浓度的醋酸溶液、加热蒸发等.)
(2)生活中的物质中碳酸盐、金属都可与酸反应,因此也会与醋酸反应.
故答案为:碳酸钠、铝、氢氧化钙等.
点评:此题是一道生活实际考查题,解题的关键是能对酸性的PH特点以及改变酸性的方法的掌握.

练习册系列答案
相关题目
 (2011?呼伦贝尔)右图是a、b两种固体物质的溶解度曲线.下列说法正确的是( )
(2011?呼伦贝尔)右图是a、b两种固体物质的溶解度曲线.下列说法正确的是( )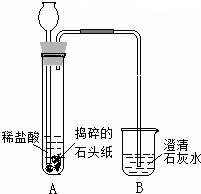 (2011?呼伦贝尔)2010年全国“两会”代表和委员们首次使用环保“石头纸”制作的便笺和文件袋.“石头纸”是一种低碳经济的绿色产品,它的主要成分是一种难溶性钙盐.某化学兴趣小组的同学对“石头纸”的成分进行如右图所示的实验探究,观察到澄清石灰水变浑浊.请回答下列问题:
(2011?呼伦贝尔)2010年全国“两会”代表和委员们首次使用环保“石头纸”制作的便笺和文件袋.“石头纸”是一种低碳经济的绿色产品,它的主要成分是一种难溶性钙盐.某化学兴趣小组的同学对“石头纸”的成分进行如右图所示的实验探究,观察到澄清石灰水变浑浊.请回答下列问题: