题目内容
【题目】请结合下列实验装置,回答问题。
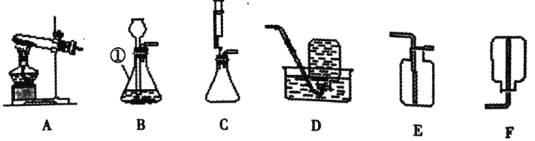
(1)请写出仪器①的名称:____________。
(2)实验室可用高锰酸钾制取氧气,该反应的化学方程式为______________。欲用该方法制取并收集一瓶干燥的氧气。要选择的发生装置和收集装置是________(填序号)。
(3)加好药品后需在试管口放一团蓬松的棉花,目的是_________________________,固定试管时要注意试管口必须____________________以防冷凝水倒流进试管底炸裂试管。
(4)实验室用D装置来收集O2,当导管口出现____________时,才能收集O2。
(5)实验室在常温下用块状电石和水反应制取乙炔气体,由于该反应十分剧烈,所以必须严格控制反应速率,你认为图中最适宜的发生装置是________(填序号)。
(6)如下图所示装置具有多种用途,下列有关它的用途的说法中,正确的是___________(填序号)。

A 该装置用于排空气法收集氢气时,气体应从a端管口通入
B 瓶内装入浓硫酸用于干燥CO2时,气体应该从a端管口通入
C 瓶内装满水,用于收集氧气时,气体应从a端管口通入
D 瓶内装满氧气,要将氧气排出,水应从a端管口通入
(7)将45.2 g干燥的紫黑色固体高锰酸钾,加热分解一段时间后,称得剩余固体质量为42 g。请算出高锰酸钾的分解率 (写出计算过程,计算结果精确到0.1%)。_____。
【答案】锥形瓶 ![]() AE 防止加热时高锰酸钾粉末进入导管 向下倾斜 气泡连续并比较均匀放出 C BD 69.9%
AE 防止加热时高锰酸钾粉末进入导管 向下倾斜 气泡连续并比较均匀放出 C BD 69.9%
【解析】
(1)仪器①的名称为锥形瓶。故填:锥形瓶
(2)实验室可用高锰酸钾制取氧气,该反应的化学方程式为![]() 。欲用该方法制取并收集一瓶干燥的氧气。要选择的发生装置和收集装置是固体加热型、向上排气法。故填:
。欲用该方法制取并收集一瓶干燥的氧气。要选择的发生装置和收集装置是固体加热型、向上排气法。故填:![]() ,AE
,AE
(3)加好药品后需在试管口放一团蓬松的棉花,目的防止加热时高锰酸钾粉末进入导管,固定试管时要注意试管口必须向下倾斜以防冷凝水倒流进试管底炸裂试管。故填:防止加热时高锰酸钾粉末进入导管、向下倾斜。
(4)实验室用D装置来收集O2,由于刚开始冒泡气体不纯(混有试管内空气),当导管口出现气泡连续并比较均匀放出时,才能收集O2。故填:气泡连续并比较均匀放出
(5)由于该反应十分剧烈,想要严格控制反应速率,要做到药品随加随反应,图中最适宜的发生装置是C。故填:C
(6) 收集密度比空气大的气体时,气体聚集在瓶的底部,应让空气从上端排出,反之,若气体的密度比空气小,则应让空气从下端排出,若瓶中有水,则水聚集在瓶的底部,应让气体由上端通入,水由下端排出,检验或干燥气体时要求导管“长进短出”。
A、氢气密度小于空气,气体应从b端管口通入,故错误;
B、瓶内装入浓硫酸用于干燥CO2时,气体应该从a端管口通入,故正确;
C、瓶内装满水,用于收集氧气时,气体应从b端管口通入,故错误;
D、瓶内装满氧气,要将氧气排出,水应从a端管口通入,故正确。
故填:BD
(7)解:根据反应前后固体差量,求出氧气的质量为3.2g
设:参加反应的高锰酸钾的质量为x
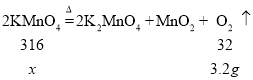
![]()
X=31.6g
高锰酸钾的分解率![]() ,答:高锰酸钾的分解率为69.9%。
,答:高锰酸钾的分解率为69.9%。
故填:69.9%

 阅读快车系列答案
阅读快车系列答案【题目】市场上有一种名为“污渍爆炸盐”的洗涤产品,它能高效去除衣物上的顽固污渍。小明对这种产品产生了兴趣,与小刚进行了如下探究。
(查阅资料)(1)“污渍爆炸盐”的主要成分是过碳酸钠(2Na2CO3 ·3H2O2),易溶于水且能与水反应生成一种碱性物质和一种强氧化性的物质;
(2)过碳酸钠的去污能力主要与其在反应中释放出的“活性氧”有关,“活性氧”含量越高,去污能力越强。
(实验1)小明向过碳酸钠水溶液中加入少量MnO2时产生大量气泡,该气体能使带火星的
木条复燃,反应的化学方程式是___________。
(提出问题)实验1反应后的溶液中溶质的成分是什么?
(做出猜想)根据过碳酸钠和水的组成作出三种猜想。
猜想一:Na2CO3;猜想二:NaOH;猜想三:Na2CO3和NaOH
(实验2)为证明猜想一是否正确,进行了如下实验:
实验步骤 | 实验现象 | 实验结论 |
小明取一定量溶液于试管中,向其中滴加CaCl2溶液 | 有白色沉淀 | 猜想一正确 |
小刚提出质疑,认为产生的白色沉淀不一定是CaCO3。他的理由是______。
(实验3)为证明猜想二是否正确,进行了如下实验:
实验步骤 | 实验现象 | 实验结论 |
小刚取一定量溶液于试管中,向其中滴加足量稀盐酸 | 观察到___ | 溶液中一定含有Na2CO3,猜想二不正确 |
Na2CO3与稀盐酸反应的化学方程式是_____________。
(实验4)为进一步确定溶液中是否含有NaOH,进行了如下实验:
实验步骤 | 实验现象 | 实验结论 |
向实验1反应后的溶液中滴加CaCl2溶液至不再产生沉淀为止,取上层清液,加入____ | 无明显现象 | 证明溶液中无NaOH,猜想一正确。 |
该实验中用CaCl2溶液而不能用石灰水,原因是___________。
【题目】小宇为了测定实验室中氯酸钾样品的纯度,取10g样品与1g二氧化锰混合,依次加热该混合物t1、t2、t3、t4时间后,分别冷却称量剩余固体质量,记录的有关数据如下表(样品中的杂质不参与化学反应)
加热时间 | t1 | t2 | t3 | t4 |
剩余固体质量(g) | 9.68 | 9.04 | 7.16 | 7.16 |
试计算:
(1)完全反应后产生的氧气的总质量为_____________g;
(2)样品中氯酸钾的纯度是____(写出计算过程)
(3)加热时间t1后,9.68g剩余固体中除杂质外还含有的物质为_____________。
【题目】同学们在实验室用下图装置制取氧气。
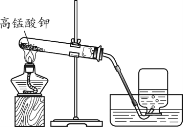
(1)加热高锰酸钾时,试管口略向下倾斜的原因是______。
实验后,同学们发现沾有高锰酸钾的白抹布洗完晾干后变为棕褐色。
(查阅资料)
草酸溶液能将棕褐色物质除去。
(提出问题)
哪些因素能加快草酸除去棕褐色物质的速率?
(进行实验)
将均匀染有棕褐色的抹布剪成大小相同的小布条进行实验
实验 编号 | 实验1
20℃ 水 | 实验2
20℃ 0.5%草酸溶液 | 实验3
20℃ 0.25%草酸溶液 | 实验4
20℃ 0.125%草酸溶液 | 实验5
30℃ 0.25%草酸溶液 | 实验6
40℃ 0.25%草酸溶液 |
现象 | 颜色 没有褪去 | 70秒后 颜色褪去 | 98秒后 颜色褪去 | 150秒后 颜色褪去 | 51秒后 颜色褪去 | 40秒后 颜色褪去 |
(解释与结论)
(2)配制200g溶质质量分数为 0.5%的草酸溶液,需要草酸的质量为______。
(3)实验1的目的是______。
(4)证明升高温度能加快草酸除去棕褐色物质的速率,需要对比______(填实验序号)。
(5)由实验2、3、4可以得出的结论是______。
(反思与评价)
(6)实验后,同学们查资料得知抹布上的棕褐色物质为二氧化锰,请你设计实验方案进行验证______。