题目内容
【题目】下列图象能正确反映其对应操作中各量变化关系的是( )
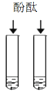
A. 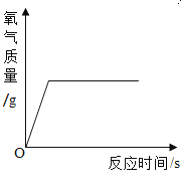 向一定量的过氧化氢溶液中加入少量二氧化锰
向一定量的过氧化氢溶液中加入少量二氧化锰
B. 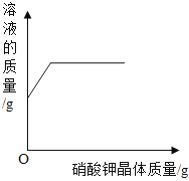
![]() 时,向硝酸钾的饱和溶液中加入硝酸钾晶体
时,向硝酸钾的饱和溶液中加入硝酸钾晶体
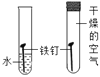
C. 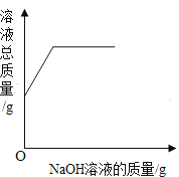 向一定量的稀盐酸中滴加氢氧化钠溶液
向一定量的稀盐酸中滴加氢氧化钠溶液
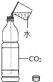
D. 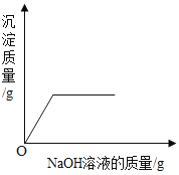 向硫酸和硫酸铜混合溶液中滴加过量的氢氧化钠溶液
向硫酸和硫酸铜混合溶液中滴加过量的氢氧化钠溶液
【答案】A
【解析】
A.这是过氧化氢在二氧化锰的催化作用下制氧气的反应,反应一开始就有氧气产生,所以曲线从原点开始画,又因为过氧化氢溶液是一定量的,所以过氧化氢消耗完之后反应停止,出现一条平行于x轴的直线。故A正确;B.tC时,向硝酸钾的饱和溶液中加入硝酸钾晶体,进入到溶液中的硝酸钾固体的质量和从溶液中析出的硝酸钾晶体的质量相等,即饱和硝酸钾溶液的质量不变,所以图象应该为从y轴上方某点起的平行于x轴的一条直线。故B错误;C.向一定量的稀盐酸中滴加氢氧化钠溶液,因为开始溶液质量不为零,所以应从y轴上方某点开始画,加入氢氧化钠溶液后溶液总质量增加,但随着氢氧化钠溶液的增加溶液总质量一直增大,不会出现平行于x轴的直线。故C错误;D.向硫酸和硫酸铜混合溶液中滴加过量氢氧化钠溶液,首先发生的是硫酸和氢氧化钠的中和反应,即开始不会产生沉淀,所以图象不应该从原点开始画,而应该从x轴右方某点开始画。故D错误。故选A。

 阅读快车系列答案
阅读快车系列答案【题目】在一支试管中放入一小段镁条(已擦去氧化膜),再向试管中加入一定量的盐酸,镁条表面有________产生,反应的化学方程式是________________________________________________________。
[发现问题]为了再次观察上述反应现象,小林同学用较长的镁条重做上述实验,但发现了异常现象,试管中出现了白色沉淀。
[实验验证1]小林同学针对两次实验的不同,设计对比实验方案,探究出现异常现象的原因。
试管(盛有同体积同浓度的盐酸) | ① | ② | ③ | ④ |
镁条长度 | 1cm | 2cm | 3cm | 4cm |
相同的实验现象(省略题干现象) | 快速反应,试管发热,镁条全部消失 | |||
沉淀量差异(恢复至20℃) | 无 | 少量 | 较多 | 很多 |
[得出结论]镁条与盐酸反应产生白色沉淀与________有关。
[追问]白色沉淀是什么物质?
[查阅资料]①20 ℃时,100 g水中最多能溶解氯化镁54.8 g;
②镁能与热水反应产生一种碱和氢气;
③氯化银既不溶于水也不溶于稀硝酸。
[做出猜想]猜想一:镁;猜想二:氯化镁;猜想三:氢氧化镁,猜想的依据是____________________(用化学方程式表示)。
[实验验证2]将白色沉淀洗涤干净,分别取少量沉淀于A、B、C试管中,进行如表实验:
试管 | 操作 | 现象 | 结论 |
A | 加入足量盐酸 | ________,白色沉淀________ | 猜想一不正确,但这种白色沉淀能溶于盐酸 |
B | 加入足量水 | 白色沉淀________ | 猜想二不正确 |
C | 加入适量稀硝酸 | 白色沉淀消失 | 原白色沉淀中含有的离子是: |
继续滴加几滴硝酸银溶液 | 出现大量白色沉淀 |