题目内容
【题目】请你参与实验室配制一定溶质质量分数的硝酸钾溶液的实验,并进行实验过程的探究:
(1)计算:配制50g质量分数为10%的硝酸钾溶液,所需硝酸钾质量为______g,所需蒸馏水的体积为______mL(水的密度约为1g/mL)。
(2)称量:分别在天平左右两盘放上纸片,调节平衡后,应______(填字母序号)。
A先在托盘上放置所需的砝码,再添加硝酸钾直至天平平衡
B先添加所需的硝酸钾,再添加砝码到所在的托盘直至天平平衡
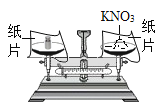
(探究一):在称量过程中,某同学的称量操作如图所示,你认为该操作对本次实验的数据处理的正确性______(填“有”或“没有”)影响,理由是______。
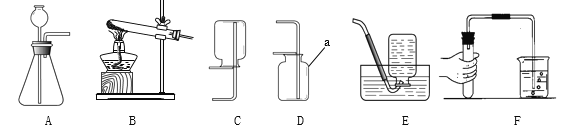
(3)量取:准确量取所需蒸馏水要用到的仪器是____(“少写”或“多写”均不得分)。
(4)溶解:将称量好的硝酸钾和蒸馏水混合溶解。
(探究二):20℃时,将20mL质量分数为10%的硝酸钾溶液,稀释成质量分数为4%的硝酸钾溶液.从表中找出计算所需的密度数据为:______g/mL。
温度℃ 质量分数% | 20 | 40 | 60 |
4 | 1.023 | 1.016 | 1.007 |
10 | 1.063 | 1.054 | 1.044 |
(探究三):已知硝酸钾在部分不同温度时的溶解度如下表
温度/℃ | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 31.6 | 63.9 | 110 | 169 | 246 |
(5)20℃时25 g硝酸钾溶解在50 g水中,所得溶液为______溶液(填“饱和”或“不饱和”),其溶质质量分数为______。
(6span>)将80℃时269g的硝酸钾饱和溶液降温至60℃时(不考虑水分蒸发),所析出晶体的质量是___g。
【答案】5g 45mL A 没有 称量过程中没有使用游码 50mL量筒、胶头滴管 1.063 饱和溶液 24% 59
【解析】
(1)溶质质量=溶液质量×溶质的质量分数,配制50g质量分数为10%的硝酸钾溶液,需硝酸钾的质量=50g×10%=5g;溶剂质量=溶液质量-溶质质量,则所需蒸馏水的质量=50g-5g=45g;水的密度为1g/mL,则根据V=![]() ;
;
(2)分别在天平左右两盘放上纸片,调节平衡后,先在托盘上放置所需的砝码,再添加硝酸钾直至天平平衡。故选A;
由图可知,此称量过程中,没有使用游码,那么左盘上砝码的质量与右盘上药品的质量相等,没有影响;
(3)要量取36mL水,应选择50mL规格的量筒;先用倾倒法向量筒内加水到近刻度线,再改用胶头滴管加水到刻度线,用到的玻璃仪器是50mL量筒和胶头滴管;
(4)20℃时,将20mL质量分数为10%的硝酸钾溶液,稀释成质量分数为4%的硝酸钾溶液,要计算需要水的质量还需要知道20mL质量分数为10%的硝酸钾溶液的密度;故选1.063;
(5)20℃时100g水最多溶解硝酸钾31.6g,所以加入的25g溶解在50g水中,硝酸钾未能全部溶解,溶液为饱和溶液,所得溶液溶质质量分数=![]()
(6)硝酸钾在80℃时的溶解度为169g,在60℃时的溶解度为110g,将80℃时269g的硝酸钾饱和溶液降温至60℃时(不考虑水分蒸发),所析出晶体的质量是169g-110g=59g。

 口算题天天练系列答案
口算题天天练系列答案【题目】在一个密闭容器中放入X、Y、Z、W四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如表![]() 则关于此反应的说法正确的是
则关于此反应的说法正确的是![]()
![]()
物质 | X | Y | Z | W |
反应前的质量 | 2 | 1 | 16 | 16 |
反应后的质量 | 12 | m | 8 | 14 |
A. 物质Y一定是该反应的催化剂
B. 该反应的基本类型为分解反应
C. 反应生成X的质量为12g
D. 该反应中Z和W两种物质变化的质量比为4:1